
3.(09江苏卷 11) 下列离子方程式与所述事实相符且正确的是
11) 下列离子方程式与所述事实相符且正确的是
 A.漂白粉溶液在空气中失效:
A.漂白粉溶液在空气中失效: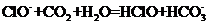
 B.用浓盐酸与
B.用浓盐酸与 反应制取少量氯气:
反应制取少量氯气:
 C.向
C.向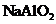 溶液中通入过量
溶液中通入过量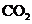 制
制 :
:

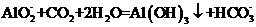
 D.在强碱溶液中次氯酸钠与
D.在强碱溶液中次氯酸钠与 反应生成
反应生成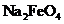 :
:

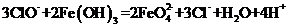
答案:C
解析:
漂白粉失效的化学方程式为 ,那么该反应的离子方程式是
,那么该反应的离子方程式是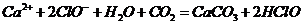 ,A项错;实验室制取
,A项错;实验室制取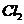 的原理是浓盐酸和二氧化锰反应,离子方程式为
的原理是浓盐酸和二氧化锰反应,离子方程式为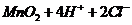

 ,所以B项错;D项,在强碱溶液中,不可能生成
,所以B项错;D项,在强碱溶液中,不可能生成 ,所以D错。
,所以D错。
2.(09天津卷 3)下列实验设计和结论相符的是
3)下列实验设计和结论相符的是
 A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
 B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
 C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
 D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
答案:B
解析:
A项,乙醇不可以作为萃取剂,错;
B项,石蕊变蓝,则肯定为碱性,正确。
C项,若原溶液中含有SO32 -,生成BaSO3,再加入HCl,则与溶液的NO3- 结合,相当于HNO3,则可以氧化BaSO3至BaSO4,沉淀不溶解,故错;
D项,加热时,FeCl3会水解,错。
1.(09全国卷Ⅱ
 13) 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
13) 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是

 A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-

 B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-

 C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-

 D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
答案:B
解析:
由于Fe2+的还原性强于Br-,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化Br-。2Fe2+ + Cl2  2Fe3+ + 2Cl-,2Br- + Cl2
2Fe3+ + 2Cl-,2Br- + Cl2  Br2 +
2Cl-,2FeBr2 + 3Cl2
Br2 +
2Cl-,2FeBr2 + 3Cl2  2FeCl3 +
2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确。当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
2FeCl3 +
2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确。当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
12.(09宁夏卷
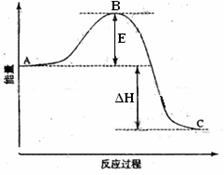 28)(14分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
28)(14分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
,理由是 ;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
,理由是 ;
 (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1;
 (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
 (4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=
mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=
mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
 (5)已知单质硫的燃烧热为296
KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(5)已知单质硫的燃烧热为296
KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
 答案:
答案:
(1)反应物能量 生成物能量
(2)无 降低 因为催化剂改变了反应的历程使活化能E降低
(3)-198
(4) SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5 (4)0.025 0.05
 (5) S(s)+O2(g)
=2SO2(g)△H1=-296 KJ·mol-1 , SO2(g)+1/2O2(g)
=SO3(g) △H2=-99 KJ·mol-1
(5) S(s)+O2(g)
=2SO2(g)△H1=-296 KJ·mol-1 , SO2(g)+1/2O2(g)
=SO3(g) △H2=-99 KJ·mol-1
 3 S(s)+9/2O2(g)=3SO3(g)
△H=3(△H1+△H2)=-1185
KJ·mol-1
3 S(s)+9/2O2(g)=3SO3(g)
△H=3(△H1+△H2)=-1185
KJ·mol-1

 解析:
解析:
(1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1;
(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5;
(4)依据速率之比等于化学计量数之比
11.(09广东化学 23)(11分)
23)(11分)
 磷单质及其化合物的有广泛应用。
磷单质及其化合物的有广泛应用。
(1)
 由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
 4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)  H
H
 ①上述反应中,副产物矿渣可用来
。
①上述反应中,副产物矿渣可用来
。
 ②已知相同条件下:
②已知相同条件下:
 4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) 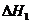
 2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
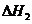
 SiO2(s)+CaO(s)=CaSiO3(s)
SiO2(s)+CaO(s)=CaSiO3(s)
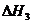
 用
用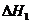 、
、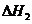 和
和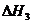 表示
表示 H
H ,
, H
H =
=
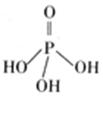
 (2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为

 (3)次磷酸钠(NaH2PO2)可用于化学镀镍。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
 ①NaH2PO2中P元素的化合价为
。
①NaH2PO2中P元素的化合价为
。
 ②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
 (a) Ni2+ + H2PO2-+ → Ni + H2PO3 -+
(a) Ni2+ + H2PO2-+ → Ni + H2PO3 -+
 (b)6H2PO2-
+2H+ = 2P+4H2PO3-+3H2↑
(b)6H2PO2-
+2H+ = 2P+4H2PO3-+3H2↑
 请在答题卡上写出并配平反应式(a)。
请在答题卡上写出并配平反应式(a)。
 ③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
 方法上的不同点:
;原理上的不同点: ;化学镀的优点:
。
方法上的不同点:
;原理上的不同点: ;化学镀的优点:
。
 答案:
答案:
 (1)①制水泥
(1)①制水泥

 ②
② 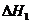 +3
+3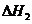 +18
+18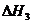
 (2)
(2)
 Na5P3O10
Na5P3O10
 (3)
(3)
①+1
 ② 1 Ni2+ + 1 H2PO2-+ 1 H2O → 1
Ni + 1 H2PO3- +
2H+
② 1 Ni2+ + 1 H2PO2-+ 1 H2O → 1
Ni + 1 H2PO3- +
2H+

 ③ 化学镀无需通电,而电镀需要通电
③ 化学镀无需通电,而电镀需要通电
 都利用氧化还原反应
都利用氧化还原反应
 化学镀对镀件的导电性无特殊要求
化学镀对镀件的导电性无特殊要求
 解析:
解析:
(1)CaSiO3可以用来制水泥。
(2)可以运用盖斯定律求解;
(3)一个磷酸中的羟基与另一个磷酸的H之间可以脱水。“五钠”即五个钠原子,由化合价代数为零可求解。
(2)残缺离子方程式的配平,注意得失电子守恒。配平后一定要检查电荷是否守恒。否则容易出错;比较化学镀与电镀应该从反应环境和条件以及反应实质和产物方面去分析归纳问题,从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍-磷合金,这是两者的不同;从原理上分析,无论电镀还是化学镀均有电子的转移,均是利用了氧化还原反应,这是两者的相同点
10.(09浙江卷 27)(15分)超音速飞机在平流层飞行时,尾气中的
27)(15分)超音速飞机在平流层飞行时,尾气中的 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的 和
和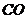 转变成
转变成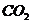 和
和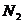 ,化学方程式如下:
,化学方程式如下:


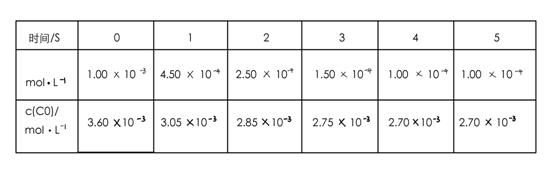
 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:


 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
 (1)在上述条件下反应能够自发进行,则反应的
(1)在上述条件下反应能够自发进行,则反应的 0(填写“>”、“<”、“=”。
0(填写“>”、“<”、“=”。
 (2)前2s内的平均反应速率v(N2)=_____________。
(2)前2s内的平均反应速率v(N2)=_____________。
 (3)在该温度下,反应的平衡常数K=
。
(3)在该温度下,反应的平衡常数K=
。
 (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
 A.选用更有效的催化剂
B.升高反应体系的温度
A.选用更有效的催化剂
B.升高反应体系的温度
 C.降低反应体系的温度
D.缩小容器的体积
C.降低反应体系的温度
D.缩小容器的体积
 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。



 ①请在上表格中填入剩余的实验条件数据。
①请在上表格中填入剩余的实验条件数据。
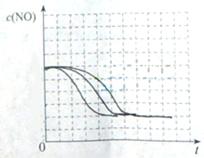
 ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。

 答案:
答案:
(1)<
(2) 1.88×10-4mol/(L·s)
(3)5000
(4)C、D
 (5)①II:
280、1.20×10-3、5.80×10-3
(5)①II:
280、1.20×10-3、5.80×10-3
 Ⅲ:1.2×10-3 、5.80×10-3
Ⅲ:1.2×10-3 、5.80×10-3
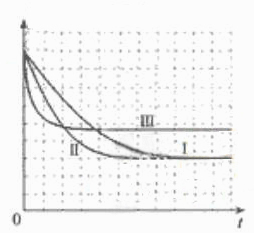
 ②
②

 解析:
解析:
(1)自发反应,通常为放热反应,即H小于0。
(2)以NO计算,2s内NO的浓度变化为(10-2.5)×10-4mol/L,V(NO)=7.5×10-4/2 =3.75×10-4mol/(L·s)。根据速率之比等于计量系数比可知,V(N2)=1/2 V(NO)=1.875×10-4mol/(L·s)。
(3) =
=

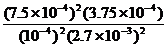 =5000。
=5000。
(4)催化剂不影响平衡的移动,A项错;该反应放热,故降温平衡正向移动,NO转化率增大,B项错,C项正确;缩小体积,即增大压强,平衡向体积减小的方向运动,即正向移动,D项正确。
(5)本题为实验探究题,目的是研究温度和催化剂的比表面积对速率的影响,研究时只能是一个变量在起作用,所以II中数据与I比较催化剂的比表面积增大了,故其他的数据应与I完全相同;III中数据与II比较,催化剂的比表面积数据未变,但是温度升高,故其他数据是不能改变的。实质I、II研究是催化剂的比表面积对速率的影响,II、III研究是温度对速率的影响。作图,可根据先拐先平的原则,即最里面的线先达平衡,速率快,应对应于III(因为其温度和催化剂的比表面积是三组中最高的),II比I快,因为两组温度相同,但是II中催化剂的比表面积大。
9.(09江苏卷 17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
 A.热裂解形成燃油 B.露天焚烧
A.热裂解形成燃油 B.露天焚烧
 C.作为有机复合建筑材料的原料
D.直接填埋
C.作为有机复合建筑材料的原料
D.直接填埋
 (2)用
(2)用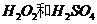 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

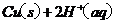 ====
====


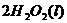 ====
====


 ====
====

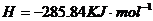
 在
在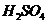 溶液中
溶液中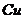 与
与 反应生成
反应生成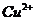 和
和 的热化学方程式为 。
的热化学方程式为 。
 (3)控制其他条件相同,印刷电路板的金属粉末用10℅
(3)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0
和3.0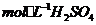 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 ( ( ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
 (4)在提纯后的
(4)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和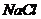 溶液,加热,生成
溶液,加热,生成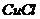 沉淀。制备
沉淀。制备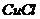 的离子方程式是
。
的离子方程式是
。
 答案:
答案:
(1)BD
 (2) Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
(2) Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
 (3)H2O2 分解速率加快
(3)H2O2 分解速率加快
 (4)2Cu2++SO32-+2Cl-+H2O
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
 解析:
解析:
(1)有关环保的比较容易。
(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。
(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。
(4)根据题目条件书写离子方程式常规题。
8.(09安徽卷25) (17分)
(17分)
 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的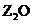 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。
 (1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比

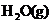 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。
 (2)Y的基态原子核 外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
(2)Y的基态原子核 外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
 (3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
 _________________________________________________________________________。
_________________________________________________________________________。

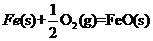




 X的单质和FeO反应的热化学方程式是_________________________________________。
X的单质和FeO反应的热化学方程式是_________________________________________。
 答案:
答案:
(1)二 VA 弱
 (2)1s22s22p63s23p4 大
(2)1s22s22p63s23p4 大
 (3)Cu + 2H2SO4(浓)
(3)Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
 (4)3FeO(s) +
2Al(s)
(4)3FeO(s) +
2Al(s)  Al2O3(s)
+ 3Fe(s) H=-859.7KJ/mol
Al2O3(s)
+ 3Fe(s) H=-859.7KJ/mol
 解析:
解析:
首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
7.  (09上海理综10)右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
(09上海理综10)右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
A.硝酸铵 B.生石灰
C.氯化镁 D.食盐
答案:B
6.(09海南卷 12)已知:
12)已知:




答案: A
A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com