
15.(09安徽卷27) (12分)
(12分)
 某厂废水中含5.00×10-3mol·L-1的
某厂废水中含5.00×10-3mol·L-1的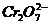 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
(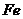 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
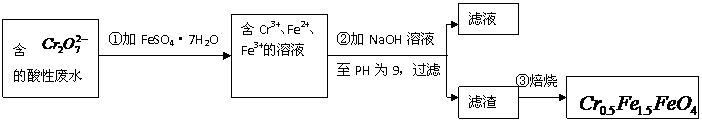






 (1)第①步反应的离子方程式是
(1)第①步反应的离子方程式是
 (2)第②步中用PH试纸测定溶液PH的操作是:
(2)第②步中用PH试纸测定溶液PH的操作是:

 (3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
 (4)欲使1L该废水中的
(4)欲使1L该废水中的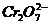 完全转化为
完全转化为 。理论上需要加入
。理论上需要加入
 GFeSO4·7H2O。
GFeSO4·7H2O。
 答案:
答案:
 (1)Cr2O72- + 6Fe2+ + 14H+
(1)Cr2O72- + 6Fe2+ + 14H+  2Cr3+ + 6Fe3+ + 7H2O
2Cr3+ + 6Fe3+ + 7H2O
 (2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
 (3)Fe(OH)3、Fe(OH)2
(3)Fe(OH)3、Fe(OH)2
 (4)13.9
(4)13.9
 解析
解析
(1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;
(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;
(4)1L废水中的n(Cr2O72-)=5.00×10-3mol,根据关系式:Cr2O72--4Cr0.5Fe1.5FeO4-10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol×278g·mol-1=13.9g。
14.(09全国卷Ⅱ 29) (15分)
29) (15分)

 现有A、B、C、D、E、F六种化合物,已知它们的阳离子有
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有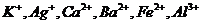 ,
, 阴离子有
阴离子有 ,现将它们分别配成
,现将它们分别配成 的溶液,进行如下实验:
的溶液,进行如下实验:
①

 测得溶液A、C、E呈碱性,且碱性为A>E>C;
测得溶液A、C、E呈碱性,且碱性为A>E>C;
②

 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③

 向D溶液中滴加
向D溶液中滴加 溶液,无明显现象;
溶液,无明显现象;
④

 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。

 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1)

 实验②中反应的化学方程式是
实验②中反应的化学方程式是

 ;
;

 (2)E溶液是 ,判断依据是
(2)E溶液是 ,判断依据是

 ;
;

 (3)写出下列四种化合物的化学式:A
、C
、
(3)写出下列四种化合物的化学式:A
、C
、

 D
、F
.
D
、F
.

 答案:
答案:
(1)



(2) 碳酸钾 由①中碱性减弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
碳酸钾 由①中碱性减弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(3)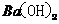
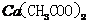
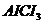
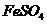

 解析:
解析:
本题考查离子共存、盐类水解综合运用。根据溶液的性质,确定CO32-只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无SO42-,则F中的阴离子为SO42-,D中的阴离子为Cl-。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO-若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。
13.(09宁夏卷 12)能正确表示下列反应的离子方程式是
12)能正确表示下列反应的离子方程式是
 A. 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O
=CaCO3↓+2HClO
A. 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O
=CaCO3↓+2HClO
 B. 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=
CaSO3↓+2HClO
B. 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=
CaSO3↓+2HClO
 C. 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C. 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
 D. 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
D. 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
 答案:D
答案:D

 解析:
解析:
A选项CO2过量的话,应该生成HCO3- 方程式应为:ClO-+CO2+H2O=HClO+HCO3-;
B选项HClO可将CaSO3氧化为CaSO4 ,正确的方程式为:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ ;
C选项要考虑到Mg(OH)2 为沉淀即可, Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O。
12.(09海南卷 9)在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
9)在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
 A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
 C.CO2、C12、CaO、SO3
D.SiO2、N2O5、CO、C12
C.CO2、C12、CaO、SO3
D.SiO2、N2O5、CO、C12
答案:B
11.(09重庆卷8)下列各组离子,能在溶液中大量共存的是
A.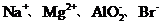 B
B 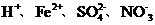
C. D
D 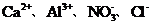
答案:D
解析:
A项Mg2+水解呈酸性,AlO2-水解呈碱性,Mg2+与AlO2-发生双水解,Mg2++2AlO2-+4H2O====2Al(OH)3↓+Mg(OH)2↓不能大量共存;A项错误;B项在酸性条件下NO3-具有强氧化性,Fe2+与NO3-不能大量共存B项错误;C项NH4+与OH-结合成弱电解质NH3·H2O不能大量共存,C项错误;答案选D。
10.(09上海卷 18)下列离子方程式正确的是
18)下列离子方程式正确的是
 A.
A. 与
与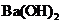 溶液反应:
溶液反应: 
 B.
B. 溶液吸收
溶液吸收 气体:
气体: 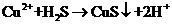
 C.
C.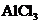 溶液中加入过量的浓氨水:
溶液中加入过量的浓氨水: 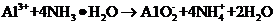
 D.等体积、等浓度的
D.等体积、等浓度的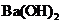 稀溶液与
稀溶液与 稀溶液混合:
稀溶液混合:

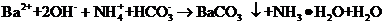
答案:BD
9. (09四川卷8)在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液: 、、H+、
、、H+、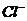 、
、
B.能使pH试纸呈红色的溶液:Na+、NH+4、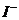 、
、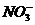
C.FeCl2溶液:K+、、Na+、、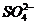 、、
、、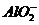
D. =0.1
mol/L的溶液:Na+、K+、
=0.1
mol/L的溶液:Na+、K+、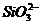 、
、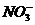
答案:D
8.(09广东化学 12) 下列离子方程式正确的是
12) 下列离子方程式正确的是
 A. 向盐酸中滴加氨水:H+ + OH- = H2O
A. 向盐酸中滴加氨水:H+ + OH- = H2O
 B. Fe(OH)3溶于氢碘酸:Fe(OH)3
+ 3H+ = Fe3+ + 3H2O
B. Fe(OH)3溶于氢碘酸:Fe(OH)3
+ 3H+ = Fe3+ + 3H2O
 C. 铜溶于稀硝酸:3Cu + 8H+
+ 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
C. 铜溶于稀硝酸:3Cu + 8H+
+ 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
 D. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
D. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
 答案:C
答案:C
 解析:
解析:
A项中的氨水应写成分子式,
B项发生的是氧化还原反应;
C项正确;
氯气具有强氧化性将S2O32-氧化成SO42-,正确的离子方程式应为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故D错。
7.(09广东理科基础 33)下列说法正确的是
33)下列说法正确的是
 A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
 B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
 C.乙醇和乙酸都能溶于水,都是电解质
C.乙醇和乙酸都能溶于水,都是电解质
 D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
 答案:A
答案:A
 解析:
解析:
Na2CO3溶液水解显碱性,故加入酚酞是变红的,A项正确;
pH=2为酸性溶液,所以CO32 -与H+是反应的,故不能共存,B项错;
乙醇属于非电解质,C项错;
硫酸为二元酸,故NaOH的物质的量是HCl的两倍,D项错。
6.(09广东理科基础 32)下列离子方程式正确的是
32)下列离子方程式正确的是
 A.铁与稀
A.铁与稀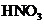 反应:
反应: ↑
↑
 B.小苏打与氢氧化钠溶液混合:
B.小苏打与氢氧化钠溶液混合:
 C.氯化钙与碳酸氢钾溶液混合:
C.氯化钙与碳酸氢钾溶液混合: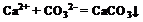
 D.
D. 溶液与
溶液与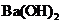 溶液混合:
溶液混合:


 答案:D
答案:D
 解析:
解析:
铁与稀HNO3反应不产生H2,而是NO气体,A项错;
HCO3- 与OH-生成CO32 -,而不是CO2,B项错;
碳酸氢钾只能写成HCO3- ,而不可写成CO32 -,C项错;
D项,生成两种沉淀,正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com