
2. 抛物线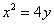 的焦点坐标是
的焦点坐标是
A. B.
B. C.
C. D.
D.
1.复数 的值是
的值是
A.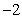 B.
B.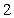 C.
C.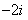 D.
D.
26.已知:在某温度下,存在可逆反应X(g)+Y(g)  2Z(g)。在该温度下,向容积为2L的恒容密闭容器中加入2 mol X和2 mol Y,在1min时达到平衡,混合气体中Z的体积分数[
2Z(g)。在该温度下,向容积为2L的恒容密闭容器中加入2 mol X和2 mol Y,在1min时达到平衡,混合气体中Z的体积分数[ ]随时间(t)变化曲线如右图所示,在2min时再向此容器中加入2 mol Z,在3min时反应重新达到平衡至4min。
]随时间(t)变化曲线如右图所示,在2min时再向此容器中加入2 mol Z,在3min时反应重新达到平衡至4min。
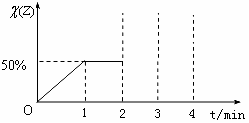
求:(1)该反应在前1min内用X表示的
平均速率。
(2)该温度下的平衡常数。
(3)请在右图中将0-4min的变化曲
线图补充完整。(必须注明图中纵坐标的对应数值)


台州市2008学年第二学期高二年级期末质量评估试题
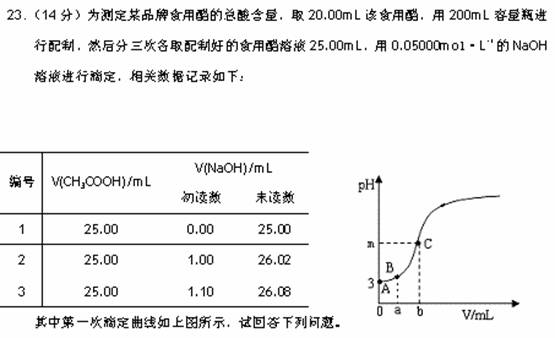
(1)本实验中,除容量瓶外,必须用到的定量仪器有 ▲ ,滴定时的正确操作是 ▲ 。
(2)该实验使用的指示剂应为 ▲ ,若上图中b为滴定终点时所耗NaOH溶液的体积,则m ▲ 7(填“>”、“<”或“=”)。
(3)a= ,A、B两点之间(不包括A、B两点),离子浓度大小关系可能为 ▲ 。
,A、B两点之间(不包括A、B两点),离子浓度大小关系可能为 ▲ 。
(4)稀释后醋酸溶液的电离度为 ▲ ,电离平衡常数的值为 ▲ 。
(5)合格食用醋总酸含量为≥3.5g·(100mL)-1,优质食用醋总酸含量为≥5.0g·(100mL)-1,
则该食用醋的级别为 ▲ 。(填“不合格”、“合格”或“优质”)
(6)下列操作会导致食用醋总酸含量的测定值偏低的是 ▲
A.在滴定前有气泡,滴定后气泡消失 B.锥形瓶水洗后未用待测液润洗
C.滴定前平视读数,滴定结束俯视读数 D.用含有NaCl的NaOH配制标准溶液


25.工业上采用(NH4)2SO4、NaCl制备NH4Cl,右下
 图为NH4Cl、Na2SO4两种物质的溶解度随温度变
图为NH4Cl、Na2SO4两种物质的溶解度随温度变
 化图。
化图。
 (1)某同学取(NH4)2SO4、NaCl配成的溶液进行
(1)某同学取(NH4)2SO4、NaCl配成的溶液进行
 以下实验制取产品:
以下实验制取产品:

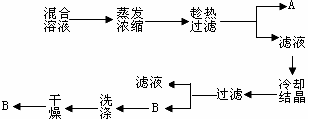
 请写出B的化学式 ▲ 。如何证明B已洗涤干净? ▲
。
请写出B的化学式 ▲ 。如何证明B已洗涤干净? ▲
。
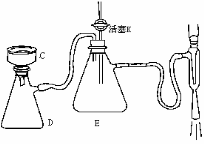

(2)冷却结晶后用右图装置进行过滤,则该装置
 名称为 ▲ ,其中仪器C的名称为
名称为 ▲ ,其中仪器C的名称为
▲ ,E的作用是 ▲ ,
实验停止时,若不拆卸装置,应如何操作?
▲ 。
(3)在实验过程中用水量的不同对产生的晶体颗粒大小和产量都有很大影响。现有两位同学分别用5mL和8mL水(水量在较高温度下都能完全溶解B晶体),对等量B晶体进行重结晶,获得的晶体颗粒大小:前者 后者;晶体质量:前者 后者。下列对上述两空格描述正确的是 ▲ 。
A.小于、大于 B.大于、小于 C.小于、小于 D.大于、大于
(4)若取B晶体加到氨水中(不考虑热效应),溶液的pH ▲ (填“增大”、“减小”或“不变”),其原因有甲乙两种观点。
甲观点:由于B盐水解显酸性。
乙观点: ▲ 。
丙同学提出为检验两种观点,只需在溶液中加入一种物质就可说明,则该物质为
▲ (写化学式)。
23.(10分)已知Co(H2O)62+显粉红色,CoCl42-显蓝色。CoCl2晶体在不同的盐酸溶液中会显示不同的颜色:①在很稀的盐酸中呈粉红色,②在浓盐酸中呈蓝色,③在一定浓度的盐酸中会呈紫色。
(1)某同学将一定量的氯化钴晶体溶于浓盐酸中,然后在该溶液中加入大量水,溶液的颜色如何变化? ▲ ,其原因为 ▲ 。(请用相关的离子方程式和适当的文字进行说明)。写出对应平衡的平衡常数表达式K= ▲ 。
 (2)某同学将盛有③获得的溶液的试管置于热水中,溶液变为蓝色,则说明该平衡的ΔH
(2)某同学将盛有③获得的溶液的试管置于热水中,溶液变为蓝色,则说明该平衡的ΔH
 ▲ 0(填“<”、“>”或“=”),此时,平衡常数K ▲ (填“变大”、“变小”或“不变”)。
▲ 0(填“<”、“>”或“=”),此时,平衡常数K ▲ (填“变大”、“变小”或“不变”)。
 (3)已知Fe(OH)3的Ksp=1.0×10-38,Co(OH)2的Ksp=1.6×10-15。若0.1mol·L-1的CoCl2溶液中含有Fe3+,调节pH使Fe3+沉淀完全[即c(Fe3+)<10-5 mol·L-1]时的pH=
(3)已知Fe(OH)3的Ksp=1.0×10-38,Co(OH)2的Ksp=1.6×10-15。若0.1mol·L-1的CoCl2溶液中含有Fe3+,调节pH使Fe3+沉淀完全[即c(Fe3+)<10-5 mol·L-1]时的pH=
 ▲ ,此时Co2+是否开始沉淀? ▲ (填“是”或“否”)。
▲ ,此时Co2+是否开始沉淀? ▲ (填“是”或“否”)。
22.(8分)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,其充、放电反应按下式进行:
Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O。
Cd+2NiO(OH)+2H2O。
(1)该电池中的电解质溶液显 ▲ 性(填写“酸性”、“中性”或“碱性”)
(2)当该电池放电时,负极上发生的电极反应式是 ▲ 。
(3)放电过程中正极处溶液的pH ▲ (填“增大”、“减小”或“不变”)。
(4)若用该电池电解AlCl3和H2SO4的混合溶液,它们的物质的量之比为3:4,则下列说法错误的是 ▲ 。
A.阴极自始至终只有H2析出 B.阳极先析出Cl2后析出O2
C.电解最后阶段为电解水 D.溶液中先有白色沉淀生成后沉淀又全部溶解
21.(8分)科学家认为,氢气是一种高效而无污染的理想能源。为减少CO对大气的污染,某研究性学习小组拟研究CO和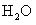 反应转化为绿色能源
反应转化为绿色能源 。
。
 已知:在101kPa下,2CO(g)+O2 (g)=2CO2(g) △H=-566kJ·mol-1
已知:在101kPa下,2CO(g)+O2 (g)=2CO2(g) △H=-566kJ·mol-1
 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
 H2O(g)=H2O(l) △H=-44kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
 (1)CO的标准燃烧热△H= ▲ 。
(1)CO的标准燃烧热△H= ▲ 。
 (2)右图为1molH2与足量O2反应生成液态水和气态水的能量变化关系图,则图中的△H= ▲ 。在该反应中加入催化剂,反应速率加快,则E1 ▲ (填“变大”、“变小”或“不变”,本小题下同) ,E2 ▲ ,△H ▲ 。
(2)右图为1molH2与足量O2反应生成液态水和气态水的能量变化关系图,则图中的△H= ▲ 。在该反应中加入催化剂,反应速率加快,则E1 ▲ (填“变大”、“变小”或“不变”,本小题下同) ,E2 ▲ ,△H ▲ 。
(3)写出CO和H2O(g)作用生成CO2和H2的热化学方程式 ▲ 。
20.各取1mL两种酸加水稀释过程中的c(H+)变化情况如右下图所示,则有关说法正确的是

A.HA是弱酸,HB是强酸
B.稀释前,c(HA)=10-2mol·L-1,
c(HB)>10-2mol·L-1
C.a=b=100
D.取稀释后溶液,中和同体积同浓度的
NaOH溶液,消耗酸的体积V(HA) <V(HB)
19.中和滴定的误差要求小于0.1%,若用0.2000 mol·L-1盐酸滴定0.2000 mol·L-1氢氧化钠溶液,则中和滴定曲线中发生突变时的pH范围是(lg2=0.3)
A.4.3-9.7 B.3.7-10.3 C.4.0-10.0 D.无法确定
18.下列不能用勒夏特列原理解释的是
A.在温热气候条件下的浅海地区往往发现有厚层的石灰岩沉积,而在深海地区却很少见到
B.在夏天喝冰镇碳酸饮料,容易打嗝
C.用双氧水处理伤口时,伤口处易出现很多气泡
D.钾肥(草木灰)与铵态氮肥(肥田粉)不能混用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com