
5、 已知
已知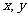 为正实数,且
为正实数,且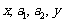 成等差数列,
成等差数列,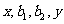 成等比数列,那么
成等比数列,那么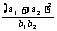 的取值范围是
的取值范围是
4、点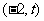 在直线
在直线 的上方,则
的上方,则 的取值范围为
的取值范围为
3.右边程序执行后输出的结果是
2. 给出以下四个问题,
给出以下四个问题,
① , 输出它的绝对值. ②求面积为
, 输出它的绝对值. ②求面积为 的正方形的周长.
的正方形的周长.
③求三个数 中输入一个数的最大数.
中输入一个数的最大数.
④求函数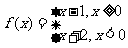 的函数值.
的函数值.
其中不需要用条件语句来描述其算法的有 个
1. 下列事件中是随机事件的个数有 个
①连续两次抛掷两个骰子,两次都出现2点;②在地球上,树上掉下的雪梨不抓住就往下掉;③某人买彩票中奖;④已经有一个女儿,那么第二次生男孩;⑤在标准大气压下,水加热到90℃是会沸腾。
4. pH的测定方法:①pH试纸;②酸碱指示剂;③pH计等。
[注意]使用pH试纸的方法: 。
[思考]若用湿润的pH试纸测定下列溶液的pH,与实际相比,结果如何变化?
①盐酸溶液 ②乙酸溶液 ③氯化钠溶液 ④氢氧化钠溶液
若原盐酸和乙酸的pH相同,则 产生的误差更大。
[例3]某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度(选填大于、小于或等于) 25℃,其理由是
若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合液为中性,则a:b= : ;此溶液中各种离子的浓度由大到小排列顺序是 。
(2)若所得混合液的pH=2,则a:b= : ;此溶液中各种离子的浓度由大到小排列顺序是 。
3.pH的计算
①已知酸碱浓度求pH ②稀释计算 ③混合计算
[例2]⑴求pH=4的盐酸与水等体积混合后溶液的pH
⑵求pH=12的Ba(OH)2溶液与水以体积比2∶3混合后溶液的pH
⑶常温下,重水离子积常数为1.6×10-15,则0.001mol/LNaOD重水溶液1mL加重水稀释至10L后溶液的pD
⑷求pH=4、pH=6的两种强酸溶液混合后溶液的pH=5时的体积比
⑸求pH=8的强碱溶液100mL和pH=9的强碱溶液300mL混合后溶液的pH
⑹求0.1mol/LHCl 800mL和0.1mol/LNaOH200mL混合后溶液的pH
⑺等体积的pH=4的盐酸与醋酸加水稀释到pH=5,加水体积:前者_______后者。
2.(1)pH=_______________,pH大小反映了溶液中__________浓度大小,即反映溶液的_______性强弱。
(2)25℃时,酸性溶液:pH_____,中性溶液:pH_____,碱性溶液:pH_____。
(3)同种溶质的稀溶液:c(酸)越大,酸性越_____,pH越_____;c(碱)越大,碱性越_____,pH越_____。
(4)相同pH的酸(或碱),若酸(或碱)越弱,其物质的量浓度越____。
[思考]判断下列说法是否正确?(对的打√,错误打×)
⑴pH=0的溶液中C(H+)=0 ( )
⑵pH相同盐酸和硫酸分别中和一定量氢氧化钠溶液,消耗两种酸体积比为2∶1 ( )
⑶pH相同的氨水和NaOH溶液中和等量的盐酸时,消耗两种碱体积比为1∶1 ( )
⑷pH=5的盐酸10mL加水稀释至1000mL后pH=7 ( )
⑸100℃时纯水的pH=6,则100℃时纯水显酸性 ( )
⑹pH=4.3的硫酸和pH=9.7的氢氧化钠溶液中水的电离程度近似相等 ( )
1、溶液的酸碱性取决于溶液中_________和__________的相对大小。
酸性溶液:C(H+)_____C(OH-),中性溶液:C(H+)__ _C(OH-),碱性溶液:C(H+)_ _C(OH-)
2、影响水的电离平衡的因素
⑴温度 ⑵酸、碱
⑶易水解的盐
[思考]分析下列条件的改变对水的电离平衡的影响:
|
项目 条件 |
平衡移 动方向 |
C(H+) 变化 |
C(OH-) 变化 |
C(H+)与C(OH-) 大小比较 |
Kw |
溶液 酸碱性 |
|
升温 |
|
|
|
|
|
|
|
加入少量H2SO4 |
|
|
|
|
|
|
|
加入少量NaOH |
|
|
|
|
|
|
|
加入少量Na2CO3 |
|
|
|
|
|
|
|
加入少量FeCl3 |
|
|
|
|
|
|
[例1]纯水在25℃和80℃时的H+浓度,前后两个量的大小关系为( )
A. 大于 B. 等于 C. 小于 D. 不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com