
2.根据性质和有关数据推知官能团个数。如-CHO--2Ag--Cu2O;
2-OH--H2;2-COOH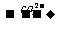 CO2;-COOH
CO2;-COOH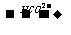 CO2
CO2
1.根据物质的性质推断官能团,如:能使溴水褐色的物质含有“C═C”或“C≡C”;
能发生银镜反应的物质含有“-CHO”;能与钠发生置换反应的物质含有“-OH”或“-COOH”;能与碳酸钠溶液作用的物质含有“-COOH”;能水解产生醇和羧酸的物质是酯等。
2.烃的衍生物的重要类别和各类衍生物的重要化学性质
|
类别 |
通式 |
官能团 |
代表物 |
分子结构结点 |
主要化学性质 |
|
卤代烃 |
R-X |
-X |
C2H5Br |
卤素原子直接与烃基结合 |
1.与NaOH溶液共热发生取代反应 2.与NaOH醇溶液共热发生消去反应 |
|
醇 |
R-OH |
-OH |
C2H5OH |
羟基直接与链烃基结合,-O-H及C-O均有极性 |
1.跟活泼金属反应产生H2 2.跟氢卤酸反应生成卤代烃 3.脱水反应  140℃分子间脱水成醚 140℃分子间脱水成醚170℃分子内脱水生成烯 4.催化氧化为醛 5.与羧酸及无机含氧酸反应生成酯 |
|
酚 |
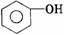 |
-OH |
 |
-OH直接与苯环上的碳相连 |
1.弱酸性 2.与浓溴水发生取代反应 3.遇FeCl3呈紫色 |
|
醛 |
 |
 |
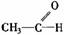 |
 有极性和不饱和性 有极性和不饱和性 |
1.与H2加成为醇 2.被氧化剂氧化为酸(如Ag(NH3)+、Cu(OH)2、O2等) |
|
羧酸 |
 |
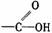 |
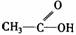 |
受羧基影响,O-H能电离出H+ |
1.具有酸的通性 2.酯化反应 |
|
酯 |
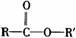 |
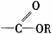 |
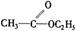 |
分子中RCO-和-OR′之间的C-O键易断裂 |
发生水解反应生成羧酸和醇 |
1.各类烃的代表物的结构、特性
|
|
烷烃 |
烯烃 |
炔烃 |
苯及同系物 |
|
代表物结构式 |
 |
 |
H-C≡C-H |
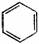 |
|
碳碳键长(×10-10m) |
1.54 |
1.33 |
1.20 |
1.40 |
|
键
角 |
109°28′ |
约120° |
180° |
120° |
|
分子形状 |
正四面体 |
平面型 |
直线型 |
平面六边形 |
|
主要化学性质 |
 光照下的卤代;裂化;不使酸性KMnO4溶液褪色 光照下的卤代;裂化;不使酸性KMnO4溶液褪色 |
跟X2、H2、HX、H2O的加成,易被氧化;可加聚 |
跟X2、H2、HX加成;易被氧化 |
跟H2加成;Fe催化下的卤代;硝化、碘化反应 |
2.写出有关的化学方程式:
A与B________________________________;C与D_______________________________;E 与无水硫酸铜______________________________;F与Mg______________________________;F与Mg的反应产物与水______________________________。
[解析] “该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝”是解答此题的突破口,此气体只能是NH3,结合题意,F就是N2。因此,从限定的反应物中,只能设法从氨水中获取.然后结合发生装置特点(固、液、不加热)及其他实验现象,便可推断其他的物质。
[解答] 1.A.浓氨水;B.氧化钙;C.氨气;D.氧化铜;E.水;F.氮气。2.(略)
[例3] Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。 现有浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂。简述如何用最 简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O。
[解析] Cu2O是碱性氧化物,一定可以跟稀硫酸反应,Cu+进入溶液后又可自发 生成Cu2+和Cu,Cu2+在水溶液中呈蓝色,而Cu不跟稀硫酸反应。因此可以设想 ,若CuO被H2还原的产物全部是Cu,将其放入稀H2SO4中,无变化;若红色产物中含有 Cu2O,将其放入稀H2SO4中,溶液会变成蓝色。
运用已学过的知识分析其它试剂是否可用,如浓H2SO4、浓HNO3、稀HNO3,因 为它们都有较强的氧化性,不论红色产物是Cu还是Cu和Cu2O的混合物,将其分别放入这3 种酸中均被氧化为Cu2+,无法检验是否存在Cu2O。FeCl3溶液中的Fe3+也 能将Cu氧化为Cu2+,也无法检验。而pH试纸则不能用。所以检验方法是取少量该红色 物质放入稀H2SO4中,振荡,若溶液变为蓝色,说明产物中有Cu2O;若溶液不变色, 说明产物中无Cu2O。
1.写出A-F的物质名称:
A________________,B________________,C________________ ,D________________,E________________,F________________。
2.训练发散思维以增强实验设计能力,提高信息迁移水平
实验方案的设计往往有许多途径。为了适应中学生的知识能力水平,中学课本中的某些 实验可能不是最优的方案。所以在实验复习中要根据实验原理来设计实验步骤和装置,掌握 一些装置和仪器药品的替代方法,力求使设计的实验仪器简单、操作便捷、节省试剂、现象明显、安全防污等,培养和增强实验设计能力和创造性思维能力。近年来,实验题中新情境试题不断增多,这类试题的特点是将基本的实验操作设计置于新的情境中(主要是中学课本 没有的新反应或新装置或是能使中学生理解的最新科技知识、简化的改进的装置等),结合学生原有的知识和能力,来进行仪器组装、现象描述、数据分析、考虑安全和防污等,用来考查考生自学能力、思维能力、分析综合及评价的能力。由于这类实验试题情境新颖、设问巧妙、铺垫得当、知识新、思维量大、所以区分度很好,能确实将一些基础扎实、自学能力强、思维敏捷、心理素质好的考生选拨出来。所以,新情境实验试题将是今后实验试题的命题方向。
试题枚举
 [例1]
某学生根据高中课本中硝酸钾受热分解的实验操作来判断硝酸铅的分解产物 之一是氧气;将试管中的硝酸铅加热到熔融,把带有火星的细木条伸进试管口,检验放出的气体,当发现木条复燃时该学生即断言,硝酸铅受热分解有氧气放出。请你对上述实验及结论的合理性作出评价。如有必要,可提出改进的实验方案。
[例1]
某学生根据高中课本中硝酸钾受热分解的实验操作来判断硝酸铅的分解产物 之一是氧气;将试管中的硝酸铅加热到熔融,把带有火星的细木条伸进试管口,检验放出的气体,当发现木条复燃时该学生即断言,硝酸铅受热分解有氧气放出。请你对上述实验及结论的合理性作出评价。如有必要,可提出改进的实验方案。
[解析] 有关反应的方程式为:
①2KNO3 2KNO2+O2↑ ②2Pb(NO3)2
2KNO2+O2↑ ②2Pb(NO3)2 2PbO+4NO2+O2↑
2PbO+4NO2+O2↑
比较反应式①和②,其不同之处是②中除生成O2外,还生成了NO2。这一不同又产生了两个结果。一方面NO2稀释了O2,O2仅占混合气体的20%,而这与空气中O2的 含量相近,因而此处O2不可能使带火星的木条复燃;另一方面NO2本身也能使带火星的 木条复燃。因为NO2受热能放出O2:2NO2 2NO+O2。分析到此, 问题便一清二楚。
2NO+O2。分析到此, 问题便一清二楚。
[答案] 上述实验及结论在科学上是错误的。由于NO2干扰了O2的检验,因此应选用NaOH溶液除掉NO2后再检验之。
[例2] 研究某一化学反应的实验装置如下图所示:
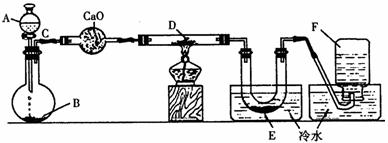
A-F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氮水 、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢 气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象:
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中。镁条表面生成一种灰黄色固体物质。将该发黄色 物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
1.实验复习必须集中和分散相结合,提高重要实验的复现率
“集中”,就是集中复习实验的基本操作和技能,集中复习一些综合性的实验专题,集中归纳总结实验知识。而“分散”则是指一些性质实验、制法实验、验证或探索性实验等应分散到元素化合物、有机物、基本理论等的复习过程中去。通过实验,进一步理解元素化合物等知识,进一步理解相关的实验原理,提高运用实验手段解决化学问题的能力,节省复习时间,提高考试成绩。
4.各部分知识与技能综合的实验设计题
近几年在高考化学试题的Ⅱ卷,设置一道大的化学实验题,这些大题的特点是把一些分 散的实验综合起来,形成一个整体的实验题;或者是某些与基本操作、技能或典型实验有关而又易被忽略的重要细节的试题,主要以教材内容为主进行不同的分解与综合,以达到新的境地。
3.能识别和绘制典型的实验仪器装置图
识别典型实验装置和绘制其简图,也是从事化学实验的一种必备的能力。在高考化学实 验题中识图的试题也是很多的,主要是有图示实验,由图来说明某具体实验;对一些基本操作或实验装置图判断正误,或将错误部分改正;对所给的单个仪器、导管、或者几个小装置的识别,然后加以组装,连接成大装置图。绘图的试题目前还不多,主要是绘制很典型的实验装置简图,或是在题中所给的位置补绘一些仪器简图。所有这些试题都要求学生熟悉常见 仪器和典型实验的装置图,并掌握一定的绘制简图的方法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com