
8. (09年海南化学·19.2)下列有关物质性质、结构的表述均正确,且存在因果关系的是:
(09年海南化学·19.2)下列有关物质性质、结构的表述均正确,且存在因果关系的是:
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
答案:B
解析:A选项中,NaCl溶于水是离子晶体的特性,I2是非极性分子溶解度小;B选项中分子的稳定性与键能有关,所以正确;C中形成化合物不一定是最高价或最低价,所以不与最外层电子数呈因果关系;D选项因P4O10发生了反应,所以不能证明P4O10是共价化合物。
7.
 (09年海南化学·19.1)在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
(09年海南化学·19.1)在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
 A.Li,F B.Na,F C.Na,C1 D.Mg,O
A.Li,F B.Na,F C.Na,C1 D.Mg,O
答案:B
解析:比较两原子电负性的差,其中Na与F的电负性差最大。
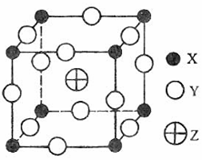
6.(08年海南化学·24)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的A
A.ZXY3 B.ZX2Y6
C.ZX4Y8 D.ZX8Y12
答案:A
解析:化合物的化学式确定的方法为均摊法。X处在正方体的八个顶点上,其个数为: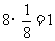 ;Y处在正方体的12条楞上,其个数为:
;Y处在正方体的12条楞上,其个数为: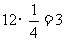 ;Z处在正方体的体心上,其个数为1。
;Z处在正方体的体心上,其个数为1。
5.(08年海南化学·23)在基态多电子原子中,关于核外电子能量的叙述错误的是C
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
 C.p轨道电子能量一定高于s轨道电子能量
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
答案:C
解析:选项C没有指明p轨道电子和s轨道电子是否处于同一电子层。
4.(08年海南化学·22)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
答案:C
解析:由于石墨的结构是平面六边形,每个碳原子以sp2杂化轨道的类型形成的三个共价键是正三角形构型,而硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。因此B原子杂化轨道的类型为sp2类型,且羟基之间作用力为氢键。
3.(2007海南·24) NaCl的晶胞如右图,每个NaCl晶胞中含有的Na+离子和Cl
NaCl的晶胞如右图,每个NaCl晶胞中含有的Na+离子和Cl 离子的数目分别是( )
离子的数目分别是( )
A.14,13 B.1,1 C.4,4 D.6,6
答案:C
考点:本题考查了NaCl晶胞的结构。
解析:每个NaCl晶胞中含有的Na+离子和Cl 离子的数目分别是4、4。
离子的数目分别是4、4。
2.(2007海南·23)用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
答案:D
考点:本题考查了价层电子对互斥理论的应用。
解析:H2S为V形;BF3为平面三角形。
1.(2007海南·22)下列叙述正确的是( )
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
答案:C
考点:本题考查了晶体的结构与性质。
解析:本题中稀有气体为单原子分子无共价键;原子晶体中如SiO2 也存在Si-O极性共价键,B错;在铵盐中既存在离子键又存在共价键,C正确。金属汞的熔点很低,D错。
22.(9分)2009年6月1日,国家《食品安全法》正式实施,在食品行业中“免检”一
词已成为历史,“凡食品必检、不合格不上市”成为最基本原则。某检测站对某品牌奶粉进行检测。取该奶粉样品100g,使其中蛋白质中的氮元素完全转变成氨气,用50g溶质质量分数为9.8%的稀硫酸恰好完全吸收[2NH3+H2SO4=(NH4)2SO4]。计算并回答下列问题:
(1)产生氨气的质量。
(2)该奶粉中含氮元素的质量分数。
(3)奶粉中蛋白质含量的国家标准为:每100g奶粉中含蛋白质12g-25g。 蛋白质中氮元素的平均质量分数为16%,则合格奶粉中氮元素的质量分数范围为 ;通过对比说明上述检测的奶粉是否合格?
(4)上述奶粉若不合格,不法奶商为使其“合格”,常在奶粉中添加化工原料三聚氰胺(化学式C3N6H6),以提升奶粉检测中的含氮量,造成蛋白质达标的假象。请你计算100g上述不合格奶粉中至少需要加入多少克三聚氰胺,才能成为“合格”奶粉。
(友情提醒:2/3-0.0192≈0.65
21.(8分)在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中
继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出问题]黑色颗粒和白色物质是什么?
[进行猜想]甲认为黑色颗粒是 ,白色物质可能是Na2O或
或 ,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是
[查阅资料]氧化钠为白色粉末,溶于水生成氢氧化钠: Na2O+H2O == 2NaOH
[实验探究]甲同学对白色物质进行实验探究。
|
实验方案 |
实验操作 |
实验现象 |
结论 |
|
方案1 |
取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质 为Na2O |
|
方案2 |
①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
白色物质 是 。 |
|
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
[反思评价]丙同学认为方案1得到的结论不正确,其理由是
[得出结论]钠在二氧化碳中燃烧的化学方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com