
20.(10分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

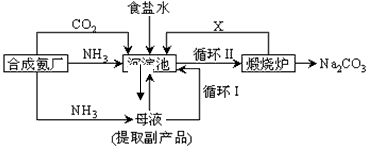
(1)沉淀池中发生的化学反应方程式是 。
(2)写出上述流程中X物质的化学式 。
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(4)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。(填字母编号)
(a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
深圳市高级中学2011届高三第一次月考
19.(10分)
(1)指出氧在下列各物质中的化合价,分别写出由氧气在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O: , 。
②Na2O2: , 。
(2)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式 。
(3)人体内O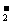 对健康有害,使人过早衰老,但在催化剂SOD存在下可以发生如下反应,请完成该反应的离子方程式:k.s.5.u
对健康有害,使人过早衰老,但在催化剂SOD存在下可以发生如下反应,请完成该反应的离子方程式:k.s.5.u

18.(10分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1-、SO42-、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
|
实验序号 |
实验内容 |
实验结果 |
|
a |
加AgNO3溶液 |
有白色沉淀生成 |
|
b |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
|
c |
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是 。
(2)溶液中一定存在的阴离子是 。
(3)试写出实验b发生反应的离子方程式 。
(4)判断混合物中是否存在K+? (填“是”或“否”)。
理由是 。
17.(10分) 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
|
方法 |
需测定的数据 |
|
① |
测定产生的H2的体积 |
|
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
|
实验操作 |
预期现象和结论 |
|
步骤1:
k.s.5.u |
|
|
步骤2:
k.s.5.u |
|
|
…… |
|
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物。取适量A进行铝热反应,产物中有单质B生成。
产物中的单质B是 (填化学式)。
16.



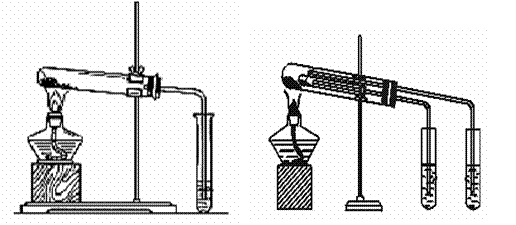 (10分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅱ所示。
(10分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅱ所示。
Ⅰ Ⅱ
(1)图Ⅰ、Ⅱ所示实验均能鉴别这两种物质,与实验Ⅰ相比,实验Ⅱ的优点是(填选项序号) 。
A.Ⅱ比Ⅰ复杂 B.Ⅱ比Ⅰ安全
C.Ⅱ比Ⅰ难操作 D.Ⅱ可以做到用同一套装置进行对比实验,而Ⅰ不行
(2)若用实验Ⅱ验证碳酸钠和碳酸氢钠的稳定性。则试管B中应装入的固体最好是(填化学式) 。
(3)某同学将质量为m1的NaHCO3固体放在试管中加热分解一段时间后,恢复到原条件,测得剩余固体的质量为m2。试管中发生的反应的化学方程式是
生成的Na2CO3的质量为 。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,请设计实验检验反应后所得溶液中溶质的阴离子:
。
15.镁铝合金质优体轻,又不易锈蚀,在大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金的性质的叙述中,正确的是
A.此合金的熔点比镁和铝的熔点都高
B.此合金能全部溶解于稀盐酸中
C.此合金能全部溶解于氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
k.s.5.u
k.s.5.u
k.s.5.u
k.s.5.u
14.向紫色石蕊试液中加入过量的过氧化钠粉末,振荡,正确的叙述是
A.溶液为紫色 B.最后溶液变为蓝色
C.最后溶液褪色 D.有气泡产生
13.下列离子反应,表达正确的是 k.s.5.u
A.向含有Fe2O3悬浊液中通入HI: Fe2O3 + 6H+=2Fe3+ + 3H2O
B.CaCO3与醋酸(CH3COOH)反应:
CaCO3 + 2CH3COOH=Ca2+ + 2CH3COO- + CO2↑+ H2O
C.向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:
2H+ + SO42-+ Ba2+ + 2OH-= BaSO4↓ + 2H2O
D.MgSO4溶液跟Ba(OH)2溶液反应:SO42― + Ba2+=BaSO4↓
12、有Fe2+ ﹑NO3- ﹑Fe3+、NH4+ ﹑H2O 和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
A.氧化剂与还原剂的物质的量之比为8∶1
B.还原产物为 NH4+
C.若有1mol NO3- 参加还原反应,则转移3mol e-
D.若把该反应设计为原电池,则负极反应为 Fe2+ - e _ = Fe3+
11.将淀粉-KI混合溶液装在半透膜袋中,浸泡在盛有蒸馏水的烧杯中,过一段时间后,取杯中液体进行实验,能证明半透膜袋有破损的是
A.加入碘水变蓝 B.加入碘水不变蓝
C.加入AgNO3溶液产生黄色沉淀 D.加入氯水变蓝色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com