
28.常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图I、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列填空和计算:
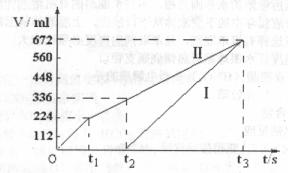
(1)写出0-t2时段的电极反应式:
阴极 ;
阳极 ;
(2)计算原混合溶液NaCl和CuSO4的物质的量浓度分别是多少?
(3)计算电解至t3时,消耗水的质量为多少g?
嘉兴市2008-2009学年第二学期期末联考
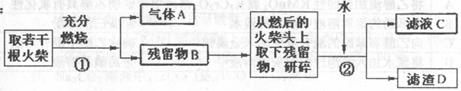
27.某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
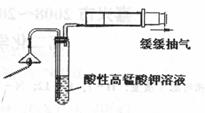
(1)为了验证气体A,按右图所示进行实验:若能观察到 现象,即可证明火柴头上含有S元素;
 (2)写出步骤①中发生的与此相关的两个主
(2)写出步骤①中发生的与此相关的两个主
要反应的方程式
(3)要证明火柴头中含有氯元素的后续实验
步骤是
(4)有学生提出检验火柴头上氯酸钾的另一
套实验方案:
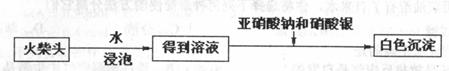
有关反应的离子方程式为 :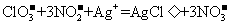
但有人提出上述方案中出现白色沉淀并不能充分说明火柴头上氯酸钾的存在,其理
由是 。
26.粗盐提纯的研究,已知:
|
化学式 |
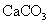 |
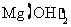 |
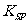 |
4.96×10-9 |
5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等,该小组设计流程如下:
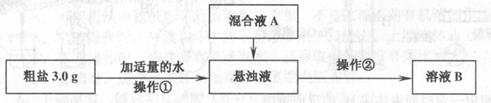
对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至
pH=2时停止加盐酸,加热蒸发可得纯净的氯化钠。
(1)混合液A的主要成分是一般可以用哪两种物质? 。(填化学式)
(2)添加钡试剂可除去粗盐中的SO42-,该钡试剂可以是下列哪几种 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2 D.以上三种均可以
(3)为检验溶液B中Mg2+是否除尽,通常可以取少量溶液B于试管中,进行如下实验:向其中加入 溶液,看是否有沉淀生成。
(4)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,该操作中控制溶液
pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为 。
25.二元酸H2ROX的电离方程式是:
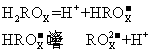
回答下列问题:
(1)Na2ROX溶液显碱性,理由是(用离子方程式表示) ;
(2)NaHROX溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) :
(3)若0.1 mol·L-1NaHROX溶液的pH=2,则0.1 mol·L-1H2ROX溶液中氢离子的物质的量浓度可能叁 (填“<”、“>”或“=”)0.11 mol·L-1,理由是: ;
(4)0.1 mol·L-1NaHROX溶液中,下列微粒浓度关系符合实际的是 。
A.c(ROx2一)+c(HROX一)=0.1 mol·L-1
B.c(Na+)+c(H+)=c(OH一)+c(HROX一)+2c(ROX-)
C.c(Na+)=c(ROX一)+c(HROX一)
D.c(Na+)>c(HROX一)>c(H’)>c(ROX2-)>c(OH一)
24.已知NO2和N2O4可以相互转化:
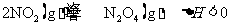
现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图所示:
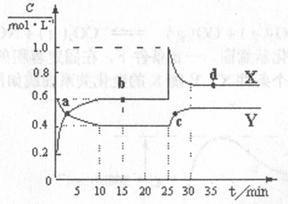
(1)图中共有两条曲线X和Y,其中表示N2O4浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于非平衡状态的点是 。
(2)前10 min内用NO2表示的化学反应速率v(NO2)= (mol·L-1·min-1);
b点的化学平衡常数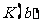 =
;d点的化学平衡常数
=
;d点的化学平衡常数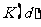 与
与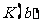 的关系:K(d) K(b)(填“>”、“=”或“<”)。
的关系:K(d) K(b)(填“>”、“=”或“<”)。
(3)不能说明该反应已经达到化学平衡状态的是 。
a、容器内的颜色不变; b、容器内压强保持不变;
c、2v逆(N2O4)=v正(NO2); d、容器内的密度保持不变
23.t℃时,某稀硫酸溶液中
c(H+)=10-amol·L-1;c(OH一)=10-bmol·L-1;已知a+b=13:
(1)该温度下水的离子积常数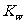 的数值为
。
的数值为
。
(2)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL0.4mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
22.某甲醇燃料电池以铂为电极,以KOH溶液为电解质溶液,在两极区分别通入甲醇
和O2即可产生电流。
(1)写出负极电极反应式:
(2)该电池放电后,溶液pH将 (填“升高”、“不变”、“降低”)。
21.工业上可利用合成气(CO和H2的混合气体)化合生产甲醇,已知:
①CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(I) △H=-285.8kJ·mol-1
③CH3OH(g)+3/2O2(g)=2H2O(I)+CO2(g) △H=-761.7 lkJ·mol-1
(1)此法生产甲醇的热化学方程式: ;
(2)此反应的熵变△S 0(填“>”、“<”或“=”)。
20.图I是

反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ:
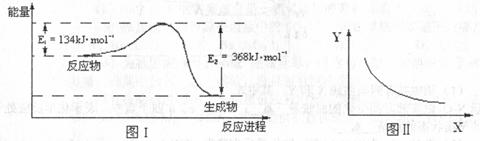
下列有关说法正确的是
A.该反应的焓变 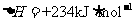
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度则Y表示的可能是CO2物质的量浓度
D.反应物的键能总和大于生成物的键能总和
19.有一瓶无色溶液,可能含有NH4+、K+、Mg2+、A13+、HCO3一、SO42-、MnO4一、
Cl一的几种。取溶液进行以下实验:
①取部分溶液,加入适量的Na2O2固体,有无色无味的气体放出和白色沉淀生成,
再加入足量的NaOH溶液,白色沉淀部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀生成。下列推断
正确的是
A.肯定有NH4+、Mg2+、A13+、Cl- B.肯定有Mg2+、A13+、HCO3一
C.肯定有K+、HCO3一、MnO4一 D.肯定有Mg2+、AI3+、SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com