
20.(12分)市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50mg/kg |
|
分装日期 |
|
|
分装企业 |
.w.^w.k.&s.5*.高.考.资.源.网 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,
KIO +5KI+3H2SO4
= 3K2SO4+ 3
+5KI+3H2SO4
= 3K2SO4+ 3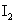 + 3H2O
+ 3H2O
上述反应生成的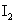 可用四氯化碳检验:确认有
可用四氯化碳检验:确认有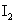 生成的现象是___________________
生成的现象是___________________
利用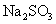 稀溶液,将
稀溶液,将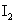 还原,可从碘的四氯化碳溶液中回收四氯化碳。
还原,可从碘的四氯化碳溶液中回收四氯化碳。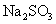 稀溶液与
稀溶液与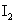 反应的离子方程式为
。
反应的离子方程式为
。
(2)已知: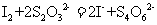 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO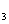 与KI反应完全;
与KI反应完全;
c.以淀粉溶液为指示剂。逐滴加入物质的量浓度为2.0×10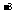 mol/L的
mol/L的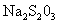 溶液10.0mL,恰好反应完全。
溶液10.0mL,恰好反应完全。
①判断c中恰好完全反应依据的现象是_____________________________________。
②b中反应所产生的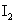 的物质的量是多少?(写出计算过程)
的物质的量是多少?(写出计算过程)
.w.^w.k.&s.5*.高.考.资.源.网
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg)。(写出计算过程)

.w.^w.k.&s.5*.高.考.资.源.网
19.

 (1)
,___________。
。
(1)
,___________。
。
C中的试剂名称是 ;仪器D的作用是 。
(2) ;
(3) 。
(4)_________________________,____________________________________。
(5) 、 、___________, 。
18.(1) (填化学式,下同), 。(2) 。
(3) ; 。
(4) , ,
。
17. ⑴ ⑵
⑶ ⑷
16.(1)

(2) , 。 (3) 。
19.(15分)二氯化二硫(S2C12)在工业上用于橡胶的硫化。为了在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
①在110℃ - 140℃时,将干燥的氯气与硫反应可得到S2C12的粗产品。
②有关物质的部分性质如下表:
|
物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
|
S |
112.8 |
444.6 |
略 |
|
S2C12 |
-77 |
137 |
 S2C12遇水生成HCl、SO2、S,300℃以上完全分解; S2C12
+ C12
2SCl2 S2C12遇水生成HCl、SO2、S,300℃以上完全分解; S2C12
+ C12
2SCl2 |
|
SCl2 |
-121 |
59.6(分解) |
设计实验装置如下图:

(1)仪器A,B的名称分别为______________,______________。
A中发生反应的离子方程式为 。
C中的试剂名称是______________;仪器D的作用是 。
(2)上图中装置不够完善,请你提出改进意见 ;
利用改进后的正确装置进行实验,请回答下列问题:
(3)E中反应的化学方程式为_____________________________________________。
(4)如果在加热E时温度过高,对实验结果的影响是_________________________,
在F中可能出现的现象是_________________________________________。
(5)S2C12粗品中可能混有的杂质是 、 、___________,为了提高S2C12的纯度,关键的操作是控制好温度和______________________。
.w.^w.k.&s.5*.高.考.资.源.网
河南省实验中学2011届高三第一次月考
化学答题卷.w.^w.k.&s.5*.高.考.资.源.网
|
座号 |
|
总分 |
.w.^w.k.&s.5*.高.考.资.源.网 |
18.(14分)某无色溶液X,K+、Ba2+、Al3+、Fe3+、[Al(OH)4]-、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验:
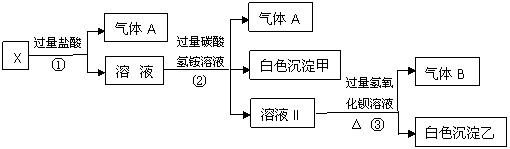
(1)气体A的成分是 (填化学式,下同),气体B的成分是 。
(2)写出步骤①中产生气体的离子方程式 。
(3)分别写出形成白色沉淀甲和气体B的离子方程式
; 。
(4)通过上述实验,可确定X溶液中一定存在的离子是 ,
尚未确定是否存在的离子是 ,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是 。
17.(8分)按要求写出有水参与的氧化还原反应的化学方程式
⑴水是氧化剂:
⑵水是还原剂:
⑶水既不是氧化剂也不是还原剂:
⑷水既是氧化剂也是还原剂:
16.(6分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内,配平后标出电子转移的方向和数目。

(2)反应中,被还原的元素是 ,还原剂是 。
(3)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
15.取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为
A.2:1:2 B.6:3:2 C.2:1:3 D.3:7:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com