
(五)问题和讨论:
该小组重复测定了三次,得到铜的质量分数的数据存在较大的偏差,你认为原因可能是 。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
31.(16分)工业上可利用煤的气化产物(水煤气)合成二甲醚。
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g) CH3OH(g) ΔH = -90.8
kJ·mol-1
CH3OH(g) ΔH = -90.8
kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH=
-23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH=
-23.5 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH= -41.3
kJ·mol-1
CO2(g)+ H2(g) ΔH= -41.3
kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
32.(16分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
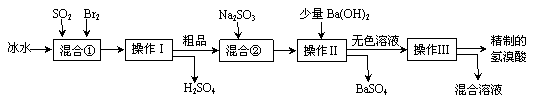
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为 。
33.(16分)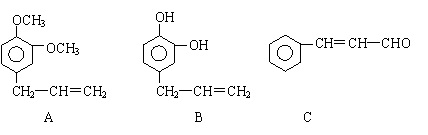 从某些植物树叶提取的挥发油中含有下列主要成分:
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)有关A、B、C三种物质的说法正确的是 (填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为 。
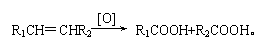 (3)0.5molB与足量的溴水充分反应,消耗
mol单质溴。
(3)0.5molB与足量的溴水充分反应,消耗
mol单质溴。
(4)已知: 有机物C9H8O发生如下反应:

则C9H8O的结构简式为 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
34.(18分)
(1)(4分)如图,螺旋测微器甲和游标卡尺乙的读数分别为 mm, cm.

(2)(6分)在验证机械能守恒定律的实验中,与纸带相连的质量为1kg的重锤自由下落,打出的纸带如图所示,相邻记数点时间间隔为0.02s,,g取9.8m/s2.求:
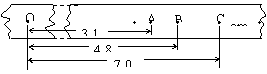
①打点计时器打下记数点B时,物体的速度VB= m/s(保留两位有效数字);
②某同学根据纸带上的O点到B点的数据,计算出物体的动能增加量△Ek=0.47J,重力势能减小量△Ep=0.48J,经过多次实验均发现△Ek略小于△Ep,试分析原因:
.
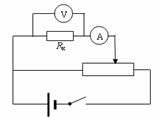 (3)(8分)测量一个电阻Rx阻值(约为70Ω),给你如下器材:
(3)(8分)测量一个电阻Rx阻值(约为70Ω),给你如下器材:
A.电流表(50mA,内阻约10Ω)
B.电压表(0-3V-15V内阻分别是3KΩ和15KΩ)
C.电源(1.5V干电池2节)
D.滑动变阻器R1 (0-10Ω)
E.滑动变阻器R2(0-1kΩ)
F.电键、导线若干
根据所给定的器材和实验要求,画出了实验电路图如图所示,问:
①实验中电压表量程应选择 ,滑动变阻器应选择 (填“R1”或“R2”).
 ②根据电路图和选择的仪器连接好下面的实物线路图.
②根据电路图和选择的仪器连接好下面的实物线路图.
35、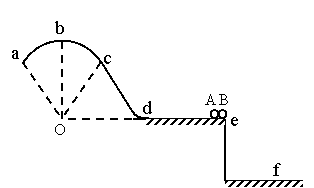 (18分)如图,竖直固定轨道abcd段光滑,长为L=1.0m的平台de段粗糙,abc段是以O为圆心的圆弧.小球A和B紧靠一起静止于e处,B的质量是A的4倍.两小球在内力作用下突然分离,A分离后向左始终沿轨道运动, 与de段的动摩擦因数μ=0.2,到b点时轨道对A的支持力等于A的重力的
(18分)如图,竖直固定轨道abcd段光滑,长为L=1.0m的平台de段粗糙,abc段是以O为圆心的圆弧.小球A和B紧靠一起静止于e处,B的质量是A的4倍.两小球在内力作用下突然分离,A分离后向左始终沿轨道运动, 与de段的动摩擦因数μ=0.2,到b点时轨道对A的支持力等于A的重力的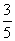 , B分离后平抛落到f点,f到平台边缘
, B分离后平抛落到f点,f到平台边缘
的水平距离S= 0.4m,平台高h=0.8m,g取10m/s2,求:
(1)(8分)AB分离时B的速度大小vB;
(2)(5分)A到达d点时的速度大小vd;
(3)(5分)圆弧 abc的半径R.
36、(18分)如图,带电量为+q、质量为m的粒子(不计重力)由静止开始经
A、B间电场加速后,沿中心线匀速射入带电金属板C、D间,后粒子由小孔
M沿径向射入一半径为R的绝缘筒,已知C、D间电压为U0,板间距离为d,C、D间与绝缘筒内均有垂直于纸面向里的匀强磁场,磁感应强度分别为B0、B.
(1)(6分)求粒子在C、D间穿过时的速度v0;
(2)(6分)求A、B间的加速电压U;
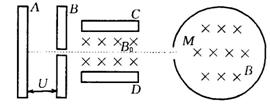 (3)(6分)粒子与绝缘筒壁碰撞,速率、电荷量都不变,为使粒子在筒内能与筒壁碰撞4次(不含从M孔出来的一次)后又从M孔飞出,求筒内磁感应强度B (用三角函数表示).
(3)(6分)粒子与绝缘筒壁碰撞,速率、电荷量都不变,为使粒子在筒内能与筒壁碰撞4次(不含从M孔出来的一次)后又从M孔飞出,求筒内磁感应强度B (用三角函数表示).
珠海市2010年9月高三摸底考试
理科综合答案及评分标准
第Ⅰ卷 选择题(共25小题,满分118分)
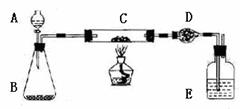
(四)计算:样品中铜的质量分数=__________________(用含W、m1.m2的代数式表示)
(三)实验内容:
在答题卡上按完成下表空白处内容
|
步骤 |
实验过程 |
实验现象 |
有关化学方程式 |
|
1 |
|
 |
 |
|
2 |
在C中加入样品W克,D中装入碱石 灰后并称量为m1克。连接好仪器,打开A的活塞,慢慢加溶液。 |
|
|
|
3 |
对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: |
|
|
|
4 |
冷却后,称量D的质量为m2克。 |
 |
 |
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(一)实验目的:测定铜粉(含炭)样品中铜的质量分数
26.(16分)请回答下列同位素示踪实验的有关问题:
(1)用32P标记的亲代噬菌体感染培养液中只含有31P的大肠杆菌,经保温、搅拌、离心,发现放射性同位素主要分布在 (沉淀物、上清液)中。繁殖n代后,含32P的噬菌体占所有噬菌体的比例是 。本实验中用到的噬菌体 (属于、不属于)原核生物。
(2)有光条件下,14C标记的CO2通过绿叶的气孔进入细胞后,首先在 发生反应,并合成含14C的产物。该产物主要在 被彻底氧化分解。
(3)用3H标记的氨基酸在豚鼠的胰腺细胞研究分泌蛋白的合成和运输时,含放射性物质依次出现在细胞的 等细胞器中,然后经细胞膜分泌出细胞外。以上生物膜在 上紧密联系,协调配合,保证了细胞生命活动高效、有序地进行。
(4)用15N标记尿嘧啶,一段时间后在植物叶肉细胞中检测到放射性物质,含放射性物质的结构有线粒体、叶绿体、 。
27.(16分)图甲是高等动植物细胞亚显微结构模式图;图乙表示生物体内某些有机物的组成关系及其功能,其中C、D、E1、E2为小分子化合物,F、G、H、I、J均为高分子化合物。请据图回答:
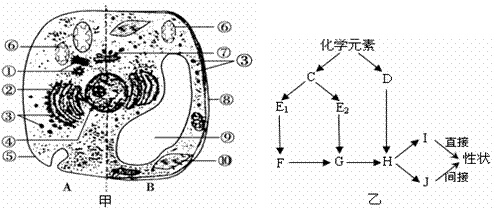
(1)图甲中含有色素的细胞器有 (填图中标号)。若将B细胞诱导成愈伤组织,则培养基中除加入水、无机盐和糖类外,还需加入 。若将该细胞制成原生质体,则需用 酶处理。
(2)图乙中控制生物性状的物质是(写字母) , E1与E2的区别是___________ _______ 。
(3)为研究通过基因工程的方法生产的干扰素对癌症的治疗效果及最佳剂量,有人计划利用下列材料进行实验,请你帮他写出实验步骤。
实验材料:从癌症患者身上取得癌细胞;动物细胞培养液;基因工程的方法生产的干扰素;试管等。
实验步骤:
第1步:取等量的癌细胞放入装有等量培养液的1--4号试管中培养;
第2步: ;
第3步: ;
第4步: 。
28.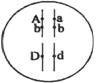 (16分)某种昆虫长翅(A)对残翅(a)为显性,直翅(B)对弯翅(b)为显性,有刺刚毛(D)对无刺刚毛(d)为显性,控制这3对性状的基因均位于常染色体上。现有这种昆虫一个体基因型如下图所示,请回答下列问题。
(16分)某种昆虫长翅(A)对残翅(a)为显性,直翅(B)对弯翅(b)为显性,有刺刚毛(D)对无刺刚毛(d)为显性,控制这3对性状的基因均位于常染色体上。现有这种昆虫一个体基因型如下图所示,请回答下列问题。
(1)长翅与残翅、直翅与弯翅两对相对性状的遗传是否遵循基因自由组合定律,并说明理由。 。
(2)该昆虫一个初级精母细胞产生的精细胞的基因型为 。
(3)该昆虫细胞有丝分裂后期,移向细胞同一极的基因有 。
(4)该昆虫细胞分裂中复制形成的两个D基因发生分离的时期有 。
(5)若该昆虫的D基因在生产实践中有非常重要的应用价值,那么,在基因工程实验中,分离基因D的做法包括用 对DNA进行切割,然后将DNA片段与 结合成重组DNA,再将重组DNA转入大肠杆菌进行扩增等。
(6)若基因D中决定某蛋白质肽链的基因编码区有16000个碱基对,其中有1000个碱基对的序列不编码蛋白质,剩下的序列最多能编码 个氨基酸(不考虑终止密码子),在该基因控制蛋白质合成的过程中最多有 种tRNA参与。
29.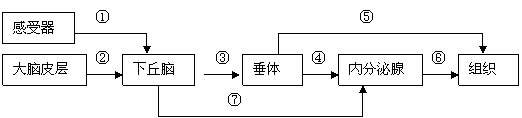 (16分)下图表示是人和高等动物神经调节和体液调节的关系。请据图回答:
(16分)下图表示是人和高等动物神经调节和体液调节的关系。请据图回答:
(1)①⑦在反射弧中可分别表示的结构是 和 。
(2)当图中的感受器感受到寒冷刺激时,图中作为效应器的内分泌腺是 ,该内分泌腺的分泌活动受下丘脑和垂体的调节。若该内分泌腺分泌的激素过多,则下丘脑和垂体的分泌活动将 ,这种调节方式属于 调节。
(3)当血糖含量升高时,参与主要调节活动的、图中的内分泌腺应为 。该结构可以分泌的激素有 。
(4)上述涉及到的调节方式对维持内环境稳态非常重要,但要对付病原体和体内出现的异常细胞,还要通过 调节才能实现。
30.(16分)某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
25.下列关于酶的叙述,正确的是
A.活细胞内合成酶的原料一定是氨基酸
B.固定在载体上的酶可以被反复利用是固定化酶技术的优点之一
C.含有蛋白酶、淀粉酶和脂肪酶的多酶片剂制作成糖衣片的目的是防止胃液的消化
D.加酶洗衣粉是将酶直接添加到洗衣粉中
第Ⅱ卷 非选择题(共11小题,满分182分)
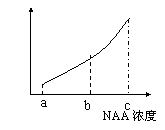
24.某同学在“探究生长素类似物NAA促进银杏插条生根的最适浓度”实验中获得了下图所示结果,下列有关本实验分析或评价的叙述不正确的是
A.本实验的自变量是促进插条生根的NAA浓度大小
B.银杏插条上侧芽的数目及饱满程度不会影响实验结果
C.促进银杏插条生根的最适浓度为c
D.用NAA处理枝条的时间应该相同
22.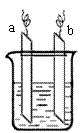 右图中,两电极上发生的电极反应分别为:
右图中,两电极上发生的电极反应分别为:
a极:2Ag++2e-=2Ag b极:Fe-2e-=Fe2+ 下列说法不正确的是
A.该装置一定是电解池 B.a、b可能是同种电极材料
C.装置中电解质溶液不一定含有Ag+
D.装置中发生的反应方程式一定是Fe+2Ag+=Fe2++2Ag
23关于浓度均为0.1 mol/L的三种溶液:①NH3·H2O、②HCl、③NH4Cl溶液,下列说法不正确的是
A.c(NH4+):③>① B.水电离出的c(OH-):②>①
C.①和②等体积混合后的溶液: c(H+)=c(OH )+ c(NH3·H2O)
)+ c(NH3·H2O)
D.①和③等体积混合后的溶液: c(Cl-)>c(NH4+)>c(OH )>c(H+)
)>c(H+)
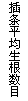
21. 如图,一质量为60 kg的同学表演“轻功”,他将4只充满气的相同气球平放在木板上,气球上放一轻质塑料板.在这位同学慢慢站上轻质塑料板中间位置的过程中(球内气体温度可视为不变),则球内气体
如图,一质量为60 kg的同学表演“轻功”,他将4只充满气的相同气球平放在木板上,气球上放一轻质塑料板.在这位同学慢慢站上轻质塑料板中间位置的过程中(球内气体温度可视为不变),则球内气体
A.压强变大 B.压强变小
C.体积变大 D.体积变小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com