
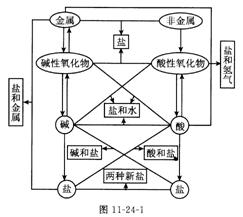
考点5.单质、氧化物、酸、碱、盐的相互关系(学科内综合考点)
单质、氧化物、酸、碱、盐的相互关系可用图11-24-1表示:
考点1.生活中常见的盐
(1)氯化钠(NaCl):①俗名:食盐。②存在:在自然界中分布很广,存在于海水、盐湖、盐井、盐矿中。③用途:a. 调味品,b. 配制生理盐水,c. 工业原料,d. 工业上用来做原料制取碳酸钠、氢氧化钠、氯气、盐酸等,e. 农业上用氯化钠溶液来选种等。
(2)碳酸钠(Na2CO2):俗名:纯碱、苏打;用途:用于生产玻璃、造纸、纺织、洗涤剂。
(3)碳酸氢钠(NaHCO3):俗名:小苏打;用途:在食品工业上用作食品添加剂,在医疗上是治疗胃酸过多的一种药剂。
(4)碳酸钙(CaCO3):它是大理石或石灰石的主要成分;用途:用作建筑材料及补钙剂。
考点2.盐的化学性质和复分解反应
(1)盐的化学性质:①盐与金属反应生成另一种金属和另一种盐;如Zn+CuSO4==ZnSO4+Cu。②盐和酸反应生成另一种盐和另一种酸;如:BaCl2+H2SO4==BaSO4↓+2HCl。③盐和碱反应生成另一种盐和另一种碱;如:CuSO4+2NaOH==Cu(OH)2↓+Na2SO4。④盐和盐反应生成两种新盐;如:NaCl+AgNO3==AgCl↓+NaNO3。
(3)复分解反应:①定义:两种化合物相互交换成分生成另外两种化合物的反应叫复分解反应。如NaOH+HCl==NaCl+H2O。②发生的条件:酸、碱、盐之间并不是都能发生反应,只有当两种化合物相互交换成分,有沉淀、水或气体生成时,复分解反应才能发生。
考点3.粗盐提纯
粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等),可以通过过滤的方法把不溶于液体的固体物质跟液体分离。过滤时,液体穿过滤纸上的小孔,而固态物质留在滤纸上,从而使固体和液体分离。粗盐提纯时,把粗盐溶解在水里,经过过滤,把泥沙等杂质从食盐水中除去,然后再通过蒸发结晶,得到食盐晶体。
粗盐提纯中需要的主要仪器有:托盘天平、量筒、铁架台、烧杯、玻璃棒、漏斗、滤纸、酒精灯、蒸发皿。
考点4.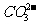 、
、 、
、 的检验方法
的检验方法
(1)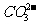 的检验方法:首先将待测样品装入试管中,再加稀盐酸,若观察到产生大量气泡,将产生的气体通入澄清石灰水中,如果澄清石灰水变浑浊,则样品中含有
的检验方法:首先将待测样品装入试管中,再加稀盐酸,若观察到产生大量气泡,将产生的气体通入澄清石灰水中,如果澄清石灰水变浑浊,则样品中含有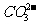 。(2)
。(2) 的检验方法:首先将待测样品装入试管中,再加入Ba(NO3)2溶液和稀硝酸,若观察到产生白色沉淀则样品中含有
的检验方法:首先将待测样品装入试管中,再加入Ba(NO3)2溶液和稀硝酸,若观察到产生白色沉淀则样品中含有 。(3)
。(3) 的检验方法:首先将待测样品装入试管中,再加入AgNO3 溶液和稀硝酸,若观察到有白色沉淀产生,则样品中含有
的检验方法:首先将待测样品装入试管中,再加入AgNO3 溶液和稀硝酸,若观察到有白色沉淀产生,则样品中含有 。
。
考点3.通过化学反应前后溶液酸碱性的变化确定溶液pH的变化(拓展考点)
溶液的pH可以发生改变,我们可以通过向溶液中加入酸溶液或者加入碱溶液改变溶液的酸碱性强弱程度。
要使溶液的pH升高,可以向溶液中加入少量的碱溶液;要使溶液的pH降低,可以向溶液中加入少量的酸溶液(或加少量的水)。
考点4.酸碱性对生命活动和农作物生长的影响(实际应用考点)
(1)对生命活动的影响:酸碱性对生命活动有直接地影响。人的胃里含有胃酸,胃酸的主要成分是盐酸,可以帮助消化,但是胃酸中含盐酸过多反而会造成消化不良,在这种情况下可服用含碱性物质[如Al(OH)3、Mg(OH)2等]的药物来中和过多的胃酸。
(2)对农作物生长的影响:酸碱性对农作物的生长有直接地影响。大多数农作物适宜在中性或接近中性的土壤中生长。根据土壤情况,可以利用中和反应,在土壤中加入酸性物质或碱性物质,以调节土壤的酸碱性,使农作物生长良好。
第十一单元 盐 化肥
第24讲 生活中常见的盐
考点1.中和反应及其应用
(1)定义:酸与碱作用生成盐和水的反应,叫中和反应,如NaOH+HCl == NaCl+H2O。
(2)中和反应的实质:酸溶液中的H+与碱溶液中的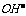 结合生成水的过程,
结合生成水的过程,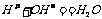 。
。
(3)中和反应与复分解反应的关系:中和反应是复分解反应的一种,复分解反应包括中和反应,即中和反应一定是复分解反应,但复分解反应不一定都是中和反应。
(4)酸碱中和实验要用指示剂:酸与碱反应生成盐和水,如果只从外观上看,无明显现象,由于酸碱指示剂在酸性、碱性和中性溶液中各显示不同的颜色,因此根据颜色变化可判断中和反应的终点。
(5)中和反应的应用:中和反应在日常生活和工农业生产中有广泛的应用,如:改良酸性土壤、处理废水、用于医药等。
考点2.溶液酸碱度的表示方法--pH
 (1)溶液的酸碱度是指溶液的酸性强弱程度。
(1)溶液的酸碱度是指溶液的酸性强弱程度。
(2)表示方法:用pH来表示,pH的范围通常在0~14之间(如图10-23-1)。PH=7时,溶液呈现中性,pH<7时,溶液呈中性,pH<7时,溶液呈酸性;pH>7时,溶液呈现碱性。
(3)pH的测定方法:测定溶液的酸碱度通常用pH试纸粗略测量。测定方法:①在玻璃片或白瓷板上放一片pH试纸。②用玻璃棒蘸取待测液滴在pH试纸上。③将试纸显示的颜色与标准比色卡比较便知溶液的pH。
考点5.气体的干燥剂(实际应用考点)
浓硫酸、固体烧碱、碱石灰、无水氯化钙可用作气体干燥剂,由于它们的性质不同,被干燥的气体也不同。一般规律见表10-22-3:
表10-22-3
|
干燥剂 |
可干燥的气体 |
不能干燥的气体 |
|
|
酸性 |
浓H2SO4 |
H2、O2、CO、CO2、HCl、CH4、N2、SO2 |
NH3 |
|
中性 |
无水氯化钙 |
除NH3外的其他气体 |
NH3 |
|
碱性 |
固体NaOH、碱石灰、生石灰 |
H2、O2、N2、CO、CH、CH4、NH3 |
CO2、SO2、HCl等 |
第23讲 酸碱之间会发生的反应
考点1.酸碱指示剂
(1)定义:跟酸或碱溶液作用显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
(2)常用的指示剂:石蕊和酚酞是两种常用的指示剂,它们与酸溶液,碱溶液作用时显示的颜色见表10-22-1:
表10-22-1
 溶液 溶液试液 |
酸溶液 |
碱溶液 |
|
紫色石蕊试液 |
变红色 |
变蓝色 |
|
无色酚酞试液 |
不变色 |
变红色 |
考点2.浓盐酸、浓硫酸的物理性质及浓硫酸的特性和稀释方法
(1)浓盐酸、浓硫酸的物理性质见表10-22-2。
表10-22-2
|
|
颜色、状态 |
气味 |
挥发性 |
|
浓盐酸 |
无色液体 |
刺激性气味 |
易挥发 |
|
浓硫酸 |
无色黏稠液体 |
无味 |
不挥发 |
(2)浓硫酸的特性:①脱水性:能够夺取纸张、木材、布料、皮肤里的水,使它们脱水生成黑色的炭,发生炭化。②吸水性:浓硫酸跟空气接触,能够吸收空气里的水分,可用作某些气体的干燥剂。③强烈的腐蚀性。④强氧化性,与金属反应时一般不生成氢气。
(3)浓硫酸的稀释:稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中。
考点3.酸的性质及用途
(1)常见的酸:在生活中和实验中常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)等。
(2)盐酸的性质及用途:①化学性质:a.与酸碱指示剂作用;b.与活泼金属发生置换反应;c.与金属氧化物(碱性氧化物)反应;d.与碱发生中和反应;e.与AgNO3发生复分解反应。②用途:重要化工产品,用于金属表面除锈,制造药物等,人体胃液中含有盐酸,可帮助消化。
(3)硫酸的性质及用途:①化学性质:a.与酸碱指示剂作用;b.与活泼金属发生置换反应;c.与金属氧化物(碱性氧化物)反应;d.与碱发生中和反应;e与BaCl2发生复分解反应。②用途:重要化工原料,用于生产化肥、农药、火药、染料以及冶炼金属和金属除锈等。
考点4.碱的性质及用途
(1)常见的碱:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
(2)氢氧化钠的性质及用途:①物理性质:氢氧化钠是一种白色固体,极易溶于水,并放出大量的热,容易吸收空气中的水而潮解。②俗名:烧碱、火碱、苛性钠。③化学性质:a与酸碱指示剂作用;b与非金属氧化物反应;c与酸发生中和反应;d与某些盐发生复分解反应。④用途:化工原料,应用于肥皂、石油、造纸、纺织和印染工业,生活中可用于去油污,固体可用作干燥剂。
(3)氢氧化钙的性质及用途:①物理性质:氢氧化钙是一种白色粉末状固体,微溶于水,水溶液俗称石灰水。②俗名:熟石灰、消石灰。③化学性质:a与酸碱指示剂作用;b与非金属氧化物反应;c与酸发生中和反应;d与某些盐发生复分解反应。④用途:用于建筑业,制取氢氧化钠,漂白粉,农业上改良酸性土壤,配制农药波尔多液和石硫合剂。
考点3.溶解度与溶质质量分数的关系(拓展考点)
在饱和溶液中:(1)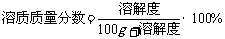 。
。
(2) 。
。
考点4.化学方程式与溶质质量分数的综合计算(学科内综合考点)
化学方程式表示的是纯净物之间的质量关系,而溶液是混合物,参加化学反应的是溶液中的溶质,所以应求出参加反应的溶质的质量代入化学方程式计算,或求出生成物溶质质量进行计算。
命题主旨往往以混合物(杂质不参加反应,可能作为生成物列入计算溶液的溶质质量分数)与某溶液反应,根据产生的气体(有时运用质量守恒定律确定)或生成的沉淀的质量来确定混合物中该物质的含量,并计算生成物溶液中溶质的质量分数。
注意:在化学反应中溶液的质量=反应前所加各物质的质量总和-反应后生成沉淀的质量-反应后逸出的气体的质量。
第十单元 酸和碱
第22讲 常见的酸和碱
考点1.溶液组成的表示方法
(1)溶液的组成:溶质和溶剂。
(2)浓溶液、稀溶液:在一定量的溶剂里所含的溶质多为浓溶液,所含的溶质少为稀溶液。溶液的“浓、稀”只是溶液组成的一种粗略表示方法。溶液的“浓、稀”与饱和不饱和无关,即浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
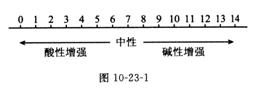
(3)用溶质质量分数准确表示溶液的组成;①定义:溶液中溶质的质量分数是指溶质质量与溶液质量之比。②公式: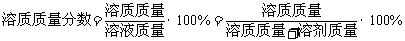
③溶液体积与溶液质量的关系:溶液质量=溶液体积×溶液密度。
考点2.配制一定溶质质量分数的溶液
(1)步骤:①计算:按配制要求计算出所需的溶质和溶剂的量(固体计算出质量,液体计算出体积)。②称量或量取;称量是指称量固体物质的质量,量取是指量取液体物质的体积。③溶解:把溶质和溶剂混合,搅拌至充分溶解即可。
(2)用到的主要仪器:烧杯、量筒、托盘天平、胶头滴管、药匙、玻璃棒等。
考点6.利用溶解度知识配制溶液、分析物质所受浮力改变情况等问题(跨学科渗透考点)
在液体中如果物体所受重力等于浮力,则物体处于悬浮状态。如果浮力小于重力则下沉,浮力大于重力则上浮。由公式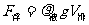 可知,只要我们改变液体的密度,则浮力就会改变,如果液体的密度变小,则浮力变小,物体要下沉;如果液体的密度变大,则浮力变大,物体要上浮。
可知,只要我们改变液体的密度,则浮力就会改变,如果液体的密度变小,则浮力变小,物体要下沉;如果液体的密度变大,则浮力变大,物体要上浮。
第21讲 溶质的质量分数
考点5.晶体及结晶(拓展考点)
(1)晶体:凡是具有规则几何外形的固体叫晶体。如食盐晶体是正六面体(立方体)。
(2)结晶:①定义:在一定条件下,固体物质从它的饱和溶液中以晶体形式析出的过程。②结晶的方法:a.对溶解度受温度变化影响不大的固态溶质,一般用蒸民结晶。b.对溶解度受温度变化影响相当大的固态溶质,一般用冷却热饱和溶液的方法结晶。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com