
16.答案:C?
解析:分析图象。先分析温度相同时p1、p2的关系(看上面两条曲线)。由p1 p2,nZ减小,对照反应p越大,nZ越大,所以p1>p2;再分析p相同时T1、T2关系(看下面两条曲线)。由T2
p2,nZ减小,对照反应p越大,nZ越大,所以p1>p2;再分析p相同时T1、T2关系(看下面两条曲线)。由T2 T1,nZ减小,对照反应,说明平衡逆向移动,即向吸热方向移动,所以由T2
T1,nZ减小,对照反应,说明平衡逆向移动,即向吸热方向移动,所以由T2 T1应是升温过程(由平衡移动原理,升温向吸热方向移动)。所以T1>T2。分析温度时还可看达到平衡需要的时间,由曲线看T1?先达到平衡,即为高温情况。故此题选C。
T1应是升温过程(由平衡移动原理,升温向吸热方向移动)。所以T1>T2。分析温度时还可看达到平衡需要的时间,由曲线看T1?先达到平衡,即为高温情况。故此题选C。
15.答案:C
解析:要测定NO2的相对分子质量,由于存在2NO2(g) N2O4(g)+Q这一化学平衡,应尽量使N2O4(g)转化为NO2,即使化学平衡向左移动,选取的条件应为较高温度、较低压强。
N2O4(g)+Q这一化学平衡,应尽量使N2O4(g)转化为NO2,即使化学平衡向左移动,选取的条件应为较高温度、较低压强。
14.答案:A
解析:反应完全后混合气体的压强减小,说明反应为气体体积缩小的反应,则2+5>
4+n,n<3。
13.答案:B
解析:2SO2+O2 2SO3为气体体积缩小的反应。甲保持体积不变,乙保持压强不变,乙相对甲来说相当于加压,故平衡右移,SO2转化率增大。
2SO3为气体体积缩小的反应。甲保持体积不变,乙保持压强不变,乙相对甲来说相当于加压,故平衡右移,SO2转化率增大。
12.答案:B
解析:同温度同体积时,气体的物质的量之比等于压强之比,故反应后的物质的量为
(2+1) mol×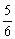 =2.5 mol,再由差量法可知反应掉的A为1 mol,即A转化率为
=2.5 mol,再由差量法可知反应掉的A为1 mol,即A转化率为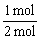 ×100%=50%。
×100%=50%。
11.答案:AC
解析:由化学平衡状态的定义可知达到平衡状态的根本标志有两个:一是v正=v逆,二是各组分的浓度不再变化。故A、C是正确的。而B只表示出了逆反应速率。因条件改变,平衡要移动,三种分子数之比保持方程式中的化学计量数比的可能性很小。
10.答案:CD
解析:题给可逆反应的正方向是吸热的。该反应属于分解反应,A物质的相对分子质量最大。当温度升高时,气体的平均相对分子质量有减小趋势,是平衡向正方向移动的必然结果,生成物B、C均为气态或有一种为气态都可。
9.答案:B
解析:设参加反应的Y的物质的量为n,
X + 2Y  2Z
2Z
起始时 a mol b mol 0
平衡时 (a
mol-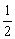 n) (b
mol-n) n
n) (b
mol-n) n
a mol-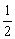 n+b mol-n=n n=
n+b mol-n=n n= (a+b) mol
(a+b) mol
所以Y的转化率为: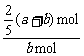 ×100%=
×100%=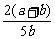 ×100%
×100%
8.答案:C
解析:SO2转化为SO3为可逆反应,不可能完全转化为SO3;如果缩小体积则会增大压强,平衡向右移动;如果充入稀有气体,增大压强,平衡不移动。SO2消耗速率代表正反应速率,O2的生成速率代表逆反应速率,平衡时为两倍关系;SO2平衡浓度不一定等于O2的两倍,因为起始浓度不一定是两倍。
7.答案:C
解析:因此反应是等体积反应,平衡前后压强不变,故选项B错;化学平衡最根本的标志是正逆反应的速率相等,故A错;选项D中表示的都是逆反应速率。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com