
14.25℃时,有pH=12 的NaOH溶液 100 mL,欲将其pH变为11,可分别采取下列四种措施(溶液混合时忽略体积变化)
(1)若加入水,则应加入的体积是 mL;
(2)若加入pH=10的NaOH溶液,则应加入的体积是 mL;
(3)若加入pH=2的HCl溶液,则应加入的体积是 mL;
(4)若加入0.01 mol/L的CH3COOH溶液,则应加入的体积在 范围之间。
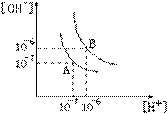
13.设水的电离平衡曲线如右下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_________增加到_________;
(2)100℃时,将pH=8的Ba(OH)2溶液与pH=5时的盐酸混合,并保持100℃的恒 温,欲使混合溶液pH=7,则Ba(OH)2与 盐酸的体积比为__________;
(3)已知AnBm的离子积=[Am+]n[Bn-]m式中的[Am+]n和[Bn-]m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/cm3,其离子积为____________;
(4)若在室温下平均每n个水分子只有一个水分子发生电离,则n值是 ____________;室温时10mL水中含有氢氧根离子约有___________个;
12.pH=11的X、Y两种碱溶液各10mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是 ( )
A.X、Y两种碱溶液的物质的量浓度一定相等
 B.稀释后,X溶液的碱性比Y溶液的碱性弱
B.稀释后,X溶液的碱性比Y溶液的碱性弱
C.若9<a<11,则X、Y都是弱碱
D.完全中和X、Y两种溶液时,消耗同浓度盐酸的体积关系为VX>VY
11.下列各种试纸,在使用时预先不能用蒸馏水润湿的是 ( )
 A.红色石蕊试纸 B.蓝色石蕊试纸 C.碘化钾淀粉试纸 D.pH试纸
A.红色石蕊试纸 B.蓝色石蕊试纸 C.碘化钾淀粉试纸 D.pH试纸
10.有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg[c(H+)/(OH-)]。现有25℃时0.1 mol·L-1的二元酸H2A溶液的AG=6.0,则下列说法正确的是 ( )
A. 在Na2A、NaHA两溶液中,离子种类不相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.某NaOH溶液与H2A溶液等体积混合后,其AG的值一定小于零
D.在25℃时,溶液的pH与AG的换算公式为pH=7-1/2AG
9.(2007年高考理综山东卷)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气,c(H+)/c(ClO-)减小B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
8.在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是 ( )
A.10∶1 B.1∶10 C.9∶1 D.1∶9
7.(盐城模拟)水在超临界状态时的电离度与标准状态不同。如:在1000℃时,密度达到1kg/L超临界水的电离度是标准状态水的1000倍,则对此超临界状态下水的说法正确的是
A.该水的离子积常数KW为1.0×10-12 B.该水具有腐蚀性 ( )
C.1L该水中加入4g氢氧化钠,则溶液pH为11 D.锌在该水中迅速溶解,产生氢气
6.常温时,纯水中由水电离的c(H+)=a,pH=1的盐酸中由水电离的c(H+)=b,0.2mol•L-1的盐酸与0.1mol•L-1的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是 ( )
A.a>b=c B.a>c>b C.c>b>a D.b>c>a
5.将pH= l的盐酸平均分成 2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为 ( )
A. 9 B.10 C.11 D.12
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com