
18.下列实验操作中,正确的是
①准确称取4.0g的NaOH固体溶于1L水配成浓度为1.0 mol·L-1的溶液
②用10 mL 量筒量取5.2mL盐酸
③用蒸发皿加热NaCl溶液可以得到NaCl晶体
④用100 mL容量瓶稀释18mol•L-1浓 H2SO4溶液
⑤用带玻璃塞的棕色试剂瓶存放浓HNO3
⑥中和热测定的实验中使用的玻璃仪器只有2种
⑦将一小块pH试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸
上,再与标准比色卡对照
A.②④⑦ B.②⑤⑥
C.②③⑤ D.①②③
17..Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O 。下列说法正确的是
。下列说法正确的是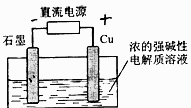
A .石墨电极发生氧化反应
B. 石墨电极上产生氢气
C. 铜电极发生还原反应
D.当有0.1mol电子转移时,有0.1molCu2O生成。
16.
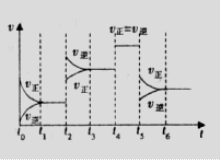 某密闭容器中发生如下反应: A(g)+B(g) 2C(g);△H<0,反应速 率(
某密闭容器中发生如下反应: A(g)+B(g) 2C(g);△H<0,反应速 率(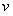 )随时间(
)随时间( )变化的关系如图,
)变化的关系如图,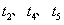 时刻外界条件改 变,但都没有改变各物质加入量。下列说法正确的是 A.
时刻外界条件改 变,但都没有改变各物质加入量。下列说法正确的是 A. 时增大了压强
时增大了压强
B.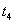 时一定使用了催化剂
时一定使用了催化剂
C.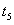 时降低了温度
时降低了温度
D.  -
-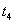 时间内A的百分含量比
时间内A的百分含量比  后低
后低
15.为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量。发生的化学反应为:
4CuI+Hg = Cu2HgI4+2Cu 。下列说法不正确的是
A.上述反应属于置换反应 B.该反应中的氧化剂为CuI
C.Cu2HgI4既是氧化产物又是还原产物
D.当有1 mol CuI参与反应时,转移电子的物质的量为0.5 mol
14..现有浓度均为0.1 mol/L ① 醋酸溶液 ② 氯化铵溶液 ③ 硫酸溶液各25 mL 。下列说法正确的是
A.3种溶液pH 大小的顺序为①﹥②﹥③
B.3种溶液中由水电离产生的氢离子浓度大到小顺序是②﹥①﹥③
C.若将3种溶液稀释相同倍数,pH 变化最大的是①
D.若分别加入25mL 0.1mol/L的氢氧化钠溶液后,pH 最大的是①
13.某温度下,相同 的硫酸溶液和硫酸铝溶液中由水电离出的
的硫酸溶液和硫酸铝溶液中由水电离出的 分别是
分别是 和
和 ,则此温度下水的离子积
,则此温度下水的离子积 为( )
为( )
A.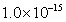 B.
B. C.
C.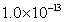 D.
D.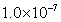
11.能正确表示以下反应的离子方程式的是
A.向KHSO4溶液中加入Ba(OH)2溶液至中性: H++S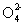 +Ba2++OH一=BaSO4↓+H2O
+Ba2++OH一=BaSO4↓+H2O
B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe 3++2H2O
C.过量CO2通人Ca(OH)2溶液中:CO2+Ca2++2OH一=CaCO3↓+H2O
D.铁粉加入到FeCl3溶液中:Fe + Fe 3+=2 Fe2+
网
科12.Na2O2是中学化学常用试剂,下列说法错误的是
A.0.1molNa2O2与足量CO2反应转移电子0.1mol
B.将Na2O2粉末加入到NaHSO3溶液中,SO32-离子数目增多
C.等物质的量的Na2O2与Na2O溶于等量水中生成NaOH浓度相同,
D.等质量的Na2O2与Na2S晶体中含有相同数目的阴离子
10.如右图中,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是
 A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
二、选择题(本题共10小题。每小题只有一个选项符合题意,各3分)
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
二、选择题(本题共10小题。每小题只有一个选项符合题意,各3分)
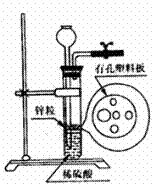
9.右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒和酸没有接触,而稀硫酸又不够,为使反应顺利进行,则可以从漏斗中加入的试剂是( )
①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液
④Na2CO3溶液 ⑤CC14 ⑥浓氨水
A.①③⑤ B.②⑥ C.③⑤ D.①②④
8.下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A. B.
B.
 C.
C.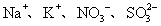 D.
D.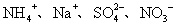
科网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com