
5.检验NH4+离子,可加入烧碱溶液后,必须加热,再用湿润的红色石蕊试纸检验NH3,否则不一定有NH3放出。
[典型例题评析]
例1 Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大发展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖。下列关于NO的叙述不正确的是(1999年全国高考题)
A.NO可以是某些含低价N物质氧化产物 B.NO不是亚硝酸酐
C.NO可以是某些含高价N物质的还原产物 D.NO是棕色气体
思路分析:本题看似很深奥,实际不然,考查的落点是中学化学常见物质NO的有关性质。根据NO中氮元素的化合价(+2)处于氮元素中间价态,应用氧化还原反应原理可推知:NO既可能是低价含N物质的氧化产物,又可能是高价含N物质的还原产物;根据酸酐概念亚硝酸酸酐应是N2O3;NO应是无色气体。
答案:D
方法要领:要答好这类“高起点,低落点”试题,首先要克服心理障碍,找准题中化学知识运用的着落点,其次,要掌握好重要基本概念和基本理论。这类试题所涉及的基本理论通常是结构理论(包括原子结构中的质量数=中子数+质子数,质子数、核电荷数、核外电子数之间关系等)、分子结构中微粒成键规律、氧化还原反应规律;所涉及的概念通常是原子相对原子质量、同位素、同素异形体等。
 例2 右图为装有活塞的密闭容器,内盛22.4mL一氧化氮。若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度(1993年上海高考题)
例2 右图为装有活塞的密闭容器,内盛22.4mL一氧化氮。若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度(1993年上海高考题)
A.等于1.369g/L B.等于2.054g/L.
C.在1.369g/L和2.054g/L之间 D.大于2.054g/L
思路分析:题给的密闭容器中通入O2后发生2个化学反应:2NO+O2=2NO2
 2NO2 N2O4。为便于计算和推导,可将题给22.4mLNO转换为22.4LNO,将题
2NO2 N2O4。为便于计算和推导,可将题给22.4mLNO转换为22.4LNO,将题
给11.2mLO2转换为11.2LO2,即容器内盛有1molNO,充入0.5molO2。根据质量守恒定律,容器内的总质量为:1mol×30g/mol+0.5mol×32g/mol=46g。
 假定1molNO与0.5molO2恰好完全反应,则生成1molNO2。在标准状况下1molNO2的体积为22.4L,此时混合气体的密度为46g/22.4L=2.054g/L。但是,由于反应2NO2 N2O4的存在,且保持温度、压强不变,因此使平衡混合气体的体积小于22.4L,故其密度必定大于2.054g/L。
假定1molNO与0.5molO2恰好完全反应,则生成1molNO2。在标准状况下1molNO2的体积为22.4L,此时混合气体的密度为46g/22.4L=2.054g/L。但是,由于反应2NO2 N2O4的存在,且保持温度、压强不变,因此使平衡混合气体的体积小于22.4L,故其密度必定大于2.054g/L。
答案:D
 方法要领:解本题时最容易忽略2NO2 N2O4的平衡(这是一个隐含的平衡),而误选B。
方法要领:解本题时最容易忽略2NO2 N2O4的平衡(这是一个隐含的平衡),而误选B。
 在涉及到的NO2或N2O4有关量的计算问题,一般要考虑可逆反应2NO2 N2O4的存在对有关量(气体物质的量、体积、密度、式量等)的影响,这是同学们应重视的一个知识点。
在涉及到的NO2或N2O4有关量的计算问题,一般要考虑可逆反应2NO2 N2O4的存在对有关量(气体物质的量、体积、密度、式量等)的影响,这是同学们应重视的一个知识点。
例3 已知磷酸分子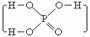 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。又此可推断出H3PO2的分子结构是(1994年全国高考题)
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。又此可推断出H3PO2的分子结构是(1994年全国高考题)
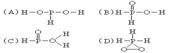
思路分析:由H3PO4在有三个氢原子可以与D2O发生氢交换及题给H3PO2分子结构知:-OH中的H原子能与D2O发生H交换。现H3PO2能与D2O发生H交换而NaH2PO2则不能(说明NaH2PO2分子中没有羟基H原子),可以类推出H3PO2中只有一个-OH,从而选B。
答案:B
方法要领:本题题给信息的实质是:含氧酸分子中的H原子,只有与氧原子结合形成羟基-OH结构时,才有酸性。由于次磷酸H3PO2只能电离出一个H+,它是一元酸;NaH2PO2中的H原子不能电离,也不能与碱反应,NaH2PO2属于正盐。同理CH3COOH分子中只有一个-OH,乙酸是一元酸。因此“含氧酸分子中含有几个H原子,就是几元酸”的说法是错误的。
此题为信息给予题,它以一般学生没有接触过的知识实例作为原型(磷酸分子中3个-OH中的H可D2O发生H交换),要求学生在原型的启发下求解。这类题一般思路为:分析原型→找出规律[只有活泼的氢(能电离的H)才能发生氢交换]→比较问题和原型→建立联系→应用规律→完成迁移。
例4 用以下三种途径来制取相等质量的硝酸铜:(1996年高考化学试测题)
(1)铜跟浓硝酸反应;(2)铜跟稀硝酸反应;(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述中正确的是
A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2)
D.所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
思路分析:本题是评价制备方案的优劣。从绿色化学角度看(1)要节约原料;(2)是副产品对环境污染小。(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,(3)2Cu+O2=2CuO,CuO+2HNO3=Cu(NO3)2+H2O。若生成3molCu(NO3)2,可得消耗原料量及生成污染物NOx的量(见下表):
|
|
Cu(NO3)2 |
Cu |
HNO3 |
NOx |
|
(1) |
3mol |
3mol |
12mol |
6mol |
|
(2) |
3mol |
3mol |
8mol |
2mol |
|
(3) |
3mol |
3mol |
6mol |
0mol |
由上表知:(1)耗HNO3最多,生成污染物最多;(3)耗HNO3最少,没有污染物。
答案:A、D
方法要领:本题考查对硝酸性质、用途的理解及氧化还原反应知识,通过分析比较选择出最佳途径的能力。
从不同浓度硝酸与铜的反应可以看出,在硝酸与铜的反应中,硝酸充当了氧化剂和提供硝酸根两种作用,因稀硝酸与铜反应时,氮元素的化合价由+5降为+2价,故作为氧化剂消耗的硝酸较少,而(3)中氧气为氧化剂,硝酸全部用提供酸根用,故消耗硝酸的为(1)>(2)>(3)。
例5 在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b 分别是(1995年全国高考题)
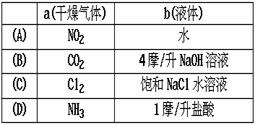
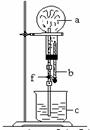
思路分析:产生喷泉的条件:气体在液体中的溶解度很大,产生足够的压强差(负压)。CO2在水中溶解度不大,不能产生喷泉,但在NaOH溶液中因发生CO2+2NaOH=Na2CO3+H2O,其溶解度显著增大,此时形成喷泉。题干要求液体充满烧瓶。
答案:B、D
方法要领:中学阶段,在水中能形成喷泉现象常见的有NH3、HCl、HBr、HI、SO2等溶解度大的气体;CO2、H2S、Cl2等在水中溶解度不大的气体,不能形成喷泉,但若将水改成NaOH溶液,这些气体在碱性溶液中溶解度显著增大,从而形成喷泉;此外,喷泉实验装置若发生改变,也可能使本来不能形成喷泉的气体形成喷泉,因此,要从产生喷泉的条件认识形成喷泉的本质。
例6 同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3,②NO2,进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为(1998年上海高考题)
A.①>② B.①<② C.①=② D.不能确定
思路分析:设圆底烧瓶的体积为VL,所含气体的物质的量为xmol。则:
c(NH3)=x/Vmol/L 而3NO2+H2O=2HNO3+NO,c(HNO3)=[2/3xmol]÷[2/3VL]= x/V mol/L。
答案:C
方法要领:只要在同温同压下,单一气体(或某一气体中混有空气)如进行喷泉实验(在H2O中)后所得溶液的浓度均相同。它与液体上升高度无关。如是标准状况则浓度为1/22.4mol/L。
注意:若误以为NO2与H2O生成HNO3的物质的量为2/3x,而忽视了溶液的体积也是2V/3L的话,就会得出两者浓度不等的结论。
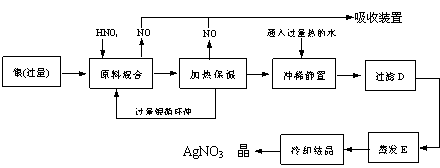 例7 某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下(1996年上海高考题)
例7 某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下(1996年上海高考题)
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是 (填序号,下同)
(a)减少过程中产生NOX的量 (b)减少原料银的消耗量 (c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速率
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是
(a)置换反应 (b)水解反应 (c)氧化还原反应
产生的沉淀物化学式 .
思路分析:(1)根据反应方程式:Ag+2 HNO3(浓)=AgNO3+NO2↑+H2O、3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O可知:每生成1molAgNO3,如用浓HNO3,消耗HNO32mol,产生1molNO2;如用稀HNO3,只需HNO34/3mol,放出NO1/3mol。故用稀硝酸比用浓硝酸好,原因为(a)、(c)。
(2)根据温度对反应速率的影响,加热保温是使反应加快,促使HNO3与Ag反应,而不希望HNO3损失,因此其目的是(a)、(c)。
(3)由水解原理,溶液浓度小,促进水解,使Fe3+、Cu2+生成难溶的Fe(OH)3、Cu(OH)2而除去。
答案:(1)稀,(a)、(c) (2)(a)、(c) (3)(b),Fe(OH)3、Cu(OH)2
4.NO3-在酸性溶液中具有强氧化性,可以将Fe2+氧化为Fe3+、SO32-氧化为SO42-,将I-、Br-、S2-氧化为I2、Br2、S。
3.氮可以形成多种氧化物。NO2可以与水反应生成硝酸,但NO2不是硝酸的酸酐。掌握酸酐的判断方法。NO2与溴蒸气不能用湿润的KI淀粉试纸检验。
2.NO、O2被水吸收的分析错误。
NO、O2被水吸收实质上发生如下反应:2NO+O2=2NO2,3NO2+2H2O=2HNO3+NO。生成NO还可以继续氧化,生成NO2再溶于水,这是一个循环反应。如无任何气体剩余,最终产物应为HNO3,恰好反应的量的关系:4NO+3O2+2H2O=4HNO3,实际反应中可以有NO或O2剩余,但不能两者兼有之。
1.氨水显弱碱性的理解不全面。
氨气溶于水形成氨水,氨水少部分电离出OH-、NH4+,所以氨水具有弱碱性。注意以下两点:
(1)氨水遇Al3+、Fe3+、Mg2+分别可以生成Al(OH)3、Fe(OH)3、Mg(OH)2沉淀,但氨水中滴加Ag+溶液开始出现沉淀AgOH,继续滴加沉淀即溶解生成银氨溶液;(2)氨水遇酸、酸性氧化物可以成盐,又根据氨水与酸的量关系分别得到正盐和酸式盐。如:用氨水吸收少量二氧化硫的离子方程式 NH3.H2O+SO2=NH4++HSO3-是错误的。
结尾:高考临近,形势逼人。写作非一朝一夕之功,只有在平时做到了“厚积”,才能在考场中“薄发”。但是,在高考前夕,针对高考要求,了解高考作文特点,从而做好充分的准备,对于我们广大的考生而言却是迫在眉睫的事情。愿广大考生在今年的高考竞技场上都能旗开得胜,蟾宫折桂!
但是,求创新的同时,我们又不能轻易的去冒险。高考毕竟是关涉到一个人前途发展的事情,如果贸然的去为了追求一味的“新”,而又不能确实体现出自己的个性特色,那样的作文恐怕会是更加的失败的。这样的例子我们几乎每年在高考中都会发现。所以我们还是提倡稳中求胜,稳中求新,切不可把一次重要的高考轻率的当作作文写作的尝试。
讲究文采,大体可以从以下一些方面来进行。(一)、多引用或化用经典的诗词名句。如写家国题材的,我们就可以联想到有关屈原、诸葛亮、杜甫、陆游、辛弃疾、苏轼、岳飞、林则徐等古人的千古名句。在平时积累整理的基础上,在考场上我们可以随手拈来,用到自己的作文中来;(二)、用警句的形式精练的概括典型人物的典型事迹。如2005年四川一考生作文《永远的谭嗣同》。考生一定要把思路驰骋到广阔的时空,穿越古今中外,尽力搜寻自己大脑中储备的材料,去粗取精,将之纳入自己的作文中来;(三)、无论是记叙、抒情还是议论,行文中应该考虑到句式的整齐和灵活。如多用排比句、修辞句等组成的整句形式,间或以灵活的散句,让文章给人一种气势贯通而不拘变化的感觉。如:《意料与情理的较量》一文“弑义帝以驱范增,信刘邦而中反间,失范增又失诸将,拥万军却无良将,气焰高而不虚心纳下,生活奢侈而不知节制”,读来顿觉气势酣畅,尽一唱三叹之妙。
4. 已知函数 .
.
① 当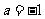 时,求函数的最大值和最小值;
时,求函数的最大值和最小值;
② 求实数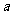 的取值范围,使
的取值范围,使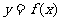 在区间
在区间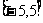 上是单调函数.
上是单调函数.
3. 利用函数的单调性求函数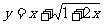 的值域;
的值域;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com