
2. 我省某著名风景区是大型的陶瓷生产基地,工厂排放的气体使风景区内酸雨频频。风景区内受酸雨影响最小的是……………………………………………………( )
A.山上的树木 B.小桥的铁栏杆 C. 路灯的玻璃罩 D. 大理石雕塑
1.无土栽培是利用化学溶液(营养液)栽培作物的一门技术。营养液是多种化合物的水溶液,其中含有作物生长所需的营养无素。某种作物在进行无土栽培时,需含氮、钾等元素的中性或弱酸性营养液,下列能用来配制营养液的是……………………( )
A.KCl (NH4)2SO4 NaOH B.NH4Cl KCl K2SO4
C. Na2CO3 K2CO3 Ca3(PO4)2 D.NH4HCO3 NH4NO3 H2SO4
31.(每空2分,共14分)我国自行研制的SARS疫苗为灭活疫苗,即利用甲醛处理SARS病毒使其变性,这是获得疫苗的常规方法。试回答相关问题。
(1)组成SARS病毒的化学元素一定有 ;如果将该病毒置于培养基中,病毒不能增殖,其原因是 。
(2)下图为某健康成人注射SARS疫苗后机体抗体浓度变化图。若此人在注射疫苗后第15天又感染了该病毒,此时一般不会患病,原因是 。

(3)常规疫苗制备成本高,针头注射易感染接种者。有学者提出利用现有的基因工程技术,生产可食用疫苗克服常规疫苗所具有的弊端。其做法是首先获得SARS病毒的病原基因,将其导入植物细胞并进行表达,最终获得可食用的疫苗。完成以下问题:
①SARS病毒的抗原基因与运载体结合后,一般先导入农杆菌,通过农杆菌
植物的离体叶片,可将SARS病毒的抗原基因导入叶片细胞的细胞核,这样SARS病毒的抗原基因就有可能与植物的细胞核的基因组整合。
②将该叶片培养成转基因植株的技术是 ,是否成功获得转基因植物的标志是 。
③基因工程获得的食用疫苗与常规疫苗相比虽然具有许多优点,但也存在一些缺点,请写出一例食用疫苗的缺点: 。
贵州省兴仁一中2009年高中毕业班强化训练
30.(每空2分,共16分)下图所示的澳大利亚墨累-达令河流域某农业生态系统,完成下列各题:
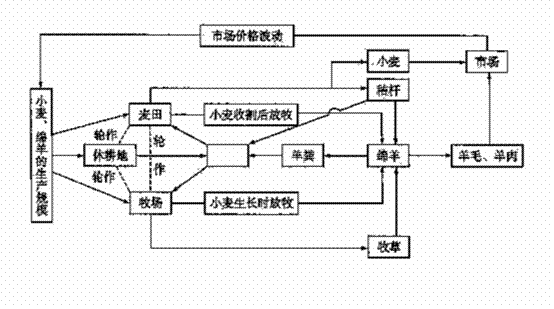
(1)农业生态系统是人类按照自身的需要,用一定的手段来调节农业生物种群和非生物环境间的相互作用,通过合理的调整 进行农产品生产的生态系统,在生态系统中 起关键作用。
(2)该生态系统与一般农田生态系统相比,其 稳定性较强,收入的波动生较小。从能量流动的角度分析,流入该生态系统的总能量是由 固定的;从物质循环角度分析,该农场留有一定面积的休耕地,其意义是土壤中的 把秸杆、羊粪等有机物分解成无机物,从而提高 。
(3)地球上最大的生态系统是 ,它具有多层次的自动调节能力,这种能力的基础是 ,这种结构和功能能较长时间维持相对稳定的状态,这一现象称为生物圈稳态,它是人类社会和经济可持续展的基础。
29.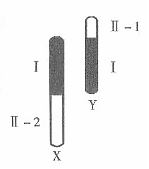 (每空2分,共18分)自然界的大麻为雌雄异株植物,
(每空2分,共18分)自然界的大麻为雌雄异株植物,
右图为其性染色体简图。X和Y染色体有一部分是同
源的(图中Ⅰ片段),该部分基因互为等位;另一部分
是非同源的(图中Ⅱ-1、Ⅱ-2)片段,该部分基因
不互为等位。在研究中发现,大麻种群中的雌雄个体
均有抗病和不抗病个体存在,已知该抗病形状受显性
基因B控制。
(1)大麻的性别决定方式为 。
(2)由题目信息可知,控制大麻是否具有抗性的基因不可能位于图中的 片段。
(3)雄株在减数分裂过程中,不可能通过互换发生基因重组的是图中的 片段。
(4)现有抗病的雌、雄大麻若干株,只做一代杂交试验,推测杂交子一代可能出现的性状,并以此为依据,对控制该性状的基因位于除第(2)问外的哪个片段做出相应的推断。如果子一代的行装表现为雌株和雄株中多数为抗病,少数不抗病,那么控制该性状的基因位于图中的 片段;如果子一代的性状表现为 ,那么控制该性状的基因位于图中的 片段。
(5)若通过实验已确定控制该性状的基因位于Ⅱ-2片段,想通过杂交试验培育一批在生殖生长之前就能识别雌雄的植株,则选择的亲本中雄株表现型为 ,其基因型为 ,子代的性状表现型为 。
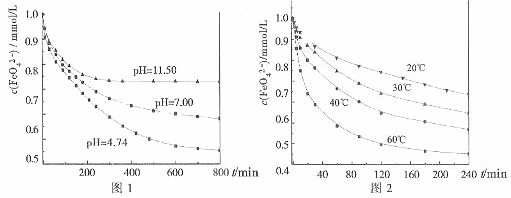
1.0m mol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,
考查不同温度对K2FeO4某种性质的影响,结果见图2。
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为:FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑
4Fe(OH)3+8OH-+3O2↑
由图1可知,800min时,初始pH=11.50的溶液中,高铁酸钾的最终浓度比pH=4.74
的溶液中高,主要原因是 。
28.(12分)高铁酸钾(K2FeO4)具有极强的氧化性,因该物质具有“绿色”、选择性高、活性强等特点受到人们关注。
(1)高锰酸钾制备方法之一为:
①在一定温度下,将氯气通入KOH溶液中制得含有次氯酸钾的溶液;
②在剧烈搅拌条件下,将Fe(NO3)3分批加入次氯酸钾溶液中,控制反应温度,
以免次氯酸钾分解;
③甲KOH至饱和,使K2FeO4充分析出,再经纯化得产品,其纯度在95%以上。
①氯碱工业中制备氯气的化学方程式是 ;
②温度过高会导致次氯酸钾自身分解生成两种化合物,产物之一是氯酸钾(KclO3),
另一种产物应该是 (写化学式)。
③制备过程有一步反应如下,请配平方程式(将计量数填入方框中):

(2)为探究高铁酸钾的某种性质,进行如下两种实验:
实验一:将适量K2FeO4分别溶解于pH为4.74、7.00、11.50的水溶液中,配的
FeO42-浓度为1.0m mol·L-1(1 m mol·L-1=1×103 mol·L-1)的试样,分别静置
800min,考查初始pH不同的水溶液对K2FeO4某种性质的影响,结果见图1。
实验二:将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为
27.(17分)A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
|
序号 |
元素 |
结构或性质 |
|
① |
A |
生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
|
② |
B |
二价阳离子与Ne原子具有相同的电子层结构 |
|
③ |
C |
形成化合物种类最多的元素之一,其单质为固体 |
|
④ |
D |
地壳中含量最多的元素 |
|
⑤ |
E |
与D同主族 |
|
⑥ |
F |
与E同周期,且最外层电子数等于电子层数 |
(1)A的某种氯化物的浓溶液可用于制作Cu印刷电路板,写出相关反应的离子方程式:
。
(2)CD2能与上述某元素形成的物质发生置换反应,该反应化学方程式是 。
(3)F的最高价氧化物对应水化物常用于治疗胃酸(含盐酸)过多症,请写出有关反应的离子方程式 。
(4)B与D形成的化合物的电子式是 。
(5)B与F形成的合金是工业上重要的材料。某

同学仅使用天平和下图所示的装置测定某些
数据即可求出该合金中B元素的含量。
①实验需要测定合金的质量m和另外2个物
理量a、b。
a是 ;
b是 ;
②干燥管中盛放的试剂最好是 。
③合金中B元素的质量分数是 。
(用m、a、b表示。)
26.(16分)现有Q、R、X、Y、Z原子序数依次增大的五种短周期元素,短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)RY2的电子式是 ,其分子的空间构型 。
(2)比较Q分别与X、Y形成的最简单化合物的稳定性 > (用分子是表示)
(3)实验室制取R2Q4的化学方程式是 。
(4)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1:1,且1个甲分子含有18个电子。请你仅用一个化学方程式表示甲既有氧化性又有还原性 。
(5)电解质乙和丙由上述元素中的几种组成,1 mol乙或丙中均含有20 mol电子,丙可以抑制乙在水溶液中的电离,则丙中的化学键类型有 ,乙的电离方程式是 。
(6)由Q、R两元素形成的含26个电子的气态化合物,用该化合物与氧气和KOH溶液可设计成燃料电池,写出该燃料电池负极的电极反应式 。
24.如图1所示,水平地面上有一辆小车,车上固定一个竖直光滑绝缘管,管的底部有一质量 g,电荷量
g,电荷量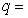 +8×10-5C的小球,小球的直径比管的内径略小。在管口所在水平面MN的下方存在着垂直纸面向里、磁感应强度
+8×10-5C的小球,小球的直径比管的内径略小。在管口所在水平面MN的下方存在着垂直纸面向里、磁感应强度 =15T的匀强磁场,MN面的上方还存在着竖直向上、场强E=25V/m的匀强电场和垂直纸面向外、磁感应强度
=15T的匀强磁场,MN面的上方还存在着竖直向上、场强E=25V/m的匀强电场和垂直纸面向外、磁感应强度 =5T的匀强磁场。现让小车始终保持v=2m/s的速度匀速向右运动,以带电小球刚经过磁场的边界PQ为计时的起点,用力传感器测得小球在管内运动的这段时间,小球对管侧壁的弹力
=5T的匀强磁场。现让小车始终保持v=2m/s的速度匀速向右运动,以带电小球刚经过磁场的边界PQ为计时的起点,用力传感器测得小球在管内运动的这段时间,小球对管侧壁的弹力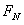 随时间变化的关系如图2所示。g取10m/s2,不计空气阻力。求:
随时间变化的关系如图2所示。g取10m/s2,不计空气阻力。求:
(1)小球进入磁场 时加速度
时加速度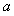 的大小;
的大小;
(2)小球出管口时(t=1s)对管侧壁的弹力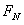 ;
;
(3)小球离开管口之后再次经过水平面MN时距管口的距离△


(1)咖啡酸中含氧官能团名称为 。
(2)写出咖啡酸与浓溴水反应的化学反应方程式: ,该反应涉及的反类型有 。
(3)写出A转化B的化学反应方程式 。
(4)已知咖啡酸能与乙二酸在一定条件下反应生成一种含有2个六元子环的有机物C,C的结构简式是 。
(5)蜂胶的主要成分(分子式C12H16O4)是由咖啡酸和一种芳香醇D反应生成的酯,已知D的芳香醇同分异物种有5种,其中三种为
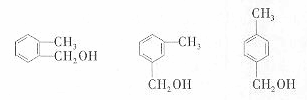
请写出另外两种 。
(6)咖啡酸的一种同分异构体,苯环上有两个取代基,苯环上以氯取代产物只有2种;能与NaCHO3反应;在酸性条件下水解生成E和甲酸,E遇FeCl3溶液不呈紫色。
该异构体的结构简式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com