
4、特性:Br2易挥发形成红棕 色的溴蒸气,保存液溴时通常加 水 形成液封以防止其挥发。I2的两大特性: 易升华 、 遇淀粉变蓝 。
3、卤素单质的物理性质:单质的颜色逐渐 加深 ,在水中的溶解度逐渐
减小,熔沸点逐渐 升高 ;Br2水是 橙黄 颜色,Br2在有机溶剂的颜色为
橙红 ,I2水的颜色为 黄褐色,I2在有机溶剂的颜色为紫红色
2、氯气的性质:
⑴氯气的物理性质:氯气是 黄绿 色,有刺激性气味,能溶于水,1体积水大概可以溶解 2 体积的氯气。⑵氯原子的结构示意图为
⑶氯气的化学性质:
①与金属反应 例: 2Na + Cl2  2NaCl (产生
白 烟)
2NaCl (产生
白 烟)
2Fe +3Cl2 2FeCl3(产生棕褐色 烟)Cu + Cl2
2FeCl3(产生棕褐色 烟)Cu + Cl2  CuCl2(产生棕黄色烟)
CuCl2(产生棕黄色烟)
氯气的氧化性较强,与变价金属反应时,一般生成高 价态的氯化物。
②与非金属反应 例: H2+ Cl2 2HCl , ( 苍白色 火焰)
2HCl , ( 苍白色 火焰)
两混合气体在 光照 条件下会发生爆炸。
③与水反应,其离子方程式为:
Cl2 + H2O HCl+
HClO 。
HCl+
HClO 。
新制氯水成份: Cl2、H2O、HClO 分子, H+ 、Cl-、OH-、ClO-离子。
④与碱反应: Cl2+ 2 NaOH =NaCl + NaClO + H2O,
制漂白粉的反应方程式为 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
漂白粉的主要成分为CaCl2 、Ca(ClO)2,有效成分为 Ca(ClO)2 ,
其漂白原理为Ca(ClO)2+CO2+H2O=CaCO3+2HClO(用方程式表示)
⑷实验室制氯气的反应方程式为:MnO2+ 4HCl(浓)=2MnCl2+Cl2 ↑+ 2 H2O 。
该反应中盐酸的作用为还原剂 和 酸性 。
1、卤族元素包括 氟F 、 氯Cl 、 溴 Br 、 碘 I 、 砹At (填名称和符号)。
24.将10.00g氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧,灼烧后残留物的质量为9.813g。若将此残留物再溶于水,并加入足量的碳酸钠溶液,所得沉淀经干燥后质量为0.721g。求原混合物中各化合物质量。
卤族元素基础知识
23.为了预防碘缺乏病,国家规定每kg食盐中应含有40-50mg的碘酸钾。为检验某种食盐中是否为加碘的合格食盐,某同学取食盐样品428g,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用 的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品,有关反应如下:
的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品,有关反应如下: ;
; 。
。
22.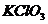 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为
和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为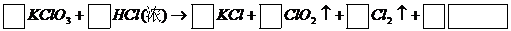
(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内)。
(2)浓盐酸在反应中显示出来的性质是_____________(填写编号,多选倒扣)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生
 ,则转移的电子的物质的量为________mol。
,则转移的电子的物质的量为________mol。
(4)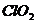 具有很强的氧化性。因此,常被用作清毒剂,其消毒的效率(以单位质量得到的电子数表示)是
具有很强的氧化性。因此,常被用作清毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的________倍。
的________倍。
21.从海水中提取溴的方法之一是:①通入氯气把浓缩的溶液中的溴化物氧化,然后用空气把生成的溴吹出;②用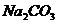 溶液吸收吹出的溴,同时放出
溶液吸收吹出的溴,同时放出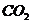 ;③向含溴化物的溶液中加硫酸溶液,溴又重新析出;④得的到的溴中可能夹杂着氯,再加入
;③向含溴化物的溶液中加硫酸溶液,溴又重新析出;④得的到的溴中可能夹杂着氯,再加入 除去。依次写出上述各步反应的化学方程式:
除去。依次写出上述各步反应的化学方程式:
①_______________________________________________________;
②_______________________________________________________;
③_______________________________________________________;
④_______________________________________________________。
20.在已经提取氯化钠、溴、镁等化学物的富碘卤水中,采用图4-5的工艺流程生产单质碘。

回答下列问题:
(1)写出乙、丁中溶质的化学式乙__________、丁___________。
(2)第④步操作中的用稀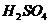 的浸洗的目的是_________(填写字母编号)。
的浸洗的目的是_________(填写字母编号)。
A.除去未反应的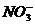 B.除去未反应的
B.除去未反应的
C.除去未反应的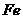 D.除去碱性物质
D.除去碱性物质
(3)第⑦步操作可供提纯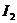 的两种方法是_________和_________(不要求写具体步骤)。
的两种方法是_________和_________(不要求写具体步骤)。
(4)实验室检验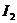 的方法是___________________________。
的方法是___________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)_______________________________________________。
18.(6分)长期以来,一直认为氟的含氧酸不可能存在,但1971年斯图杰尔和阿佩里曼成功制得次氟酸。他们是在0℃以下将氟水从细冰末上通过而获得微量次氟酸。次氟酸很不稳定,刹那就被液态水分解。次氟酸能与水反应得到溶液A,A中含有B、C两种溶质。B常用于雕刻玻璃,C在二氧化锰催化作用下能迅速分解生成一种能使带火星木条复燃的气体。
① 的电子式为_____________________。
的电子式为_____________________。
②次氟酸与水反应的化学方程式_________________________。
作业19.(10分)已知①A,B,C,D四种物质均含元素X,有的还可能含有元素Y,Z。
元素Y,X,Z的原子序数依次递增。
②X在A,B,C,D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是____________,Z是_____________。
(2)写出③中反应的化学方程式:_______________________。
(3)写出④中反应的化学方程式:_______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com