
32.(16分)
(1)SO2+Br2+2H2O → 2HBr+H2SO4。(3分) (2)降低体系温度,防止溴蒸发,使反应完全。(2分)
(3)过滤、蒸馏。d。(3分) (4)除去粗品中未反应完的溴。(3分)
(5)KSCN溶液,溶液变成血红色。(3分) 含有Br2,CCl4。(3分)
31.(16分)
⑴ C + H2O 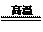 CO + H2
(3分) ⑵ H2S + Na2CO3 = NaHS +
NaHCO3 (3分)
CO + H2
(3分) ⑵ H2S + Na2CO3 = NaHS +
NaHCO3 (3分)
⑶ -246.4 kJ·mol-1 c e ⑷ ① > ② 0.04 mol·L-1 0.16 mol/L·min
30. (16分)(三)
|
步骤 |
实验过程 |
实验现象 |
有关化学方程式 |
|
1 |
按图连接好仪器后, 检查装置的气密性(3分) |
----------- |
---------- |
|
2 |
---------- |
B、E中有气泡产生(2分) |
 (1分) |
|
3 |
---------- |
C中红色粉末变成黑色(2分) |
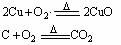 (各1分) |
|
4 |
---------- |
---------- |
---------- |
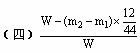 (3分)
(五)ABC (3分)
(3分)
(五)ABC (3分)
29.(16分)
(1)传入神经 传出神经 (2)甲状腺(或甲状腺和肾上腺) 减弱 反馈(或负反馈)
(3)胰岛 胰岛素、胰高血糖素 (4)免疫
28.(16分)
(1)不遵循,控制这两对相对性状的基因位于一对同源染色体上 (2)AbD、abd或Abd、abD
(3)A、a、b、b、D、d (4)有丝分裂后期和减数第二次分裂后期
(5)限制酶(或限制性内切酶) 运载体(或质粒) (6)5000 61
27.(16分)
(1)⑨⑩ 生长素和细胞分裂素 纤维素酶和果胶酶
(2)F 碱基组成不同,五碳糖不同
(3)第2步:在2-4号试管中加入不同剂量的干扰素,1号不加干扰素作为空白对照
第3步:把1-4号试管放在相同且适宜的环境培养一段时间
第4步:观察并记录癌细胞的生长状况
第Ⅱ卷 非选择题(共11小题,满分182分)
26-29题:除注明者外,每空2分,共64分。
26.(16分)
(1)沉淀物 2/2n 不属于 (2)叶绿体基质(只答叶绿体给1分) 线粒体
(3)核糖体、内质网、高尔基体 结构和功能 (4)核糖体、细胞核
(五)问题和讨论:
该小组重复测定了三次,得到铜的质量分数的数据存在较大的偏差,你认为原因可能是 。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
31.(16分)工业上可利用煤的气化产物(水煤气)合成二甲醚。
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g) CH3OH(g) ΔH = -90.8
kJ·mol-1
CH3OH(g) ΔH = -90.8
kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH=
-23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH=
-23.5 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH= -41.3
kJ·mol-1
CO2(g)+ H2(g) ΔH= -41.3
kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
32.(16分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
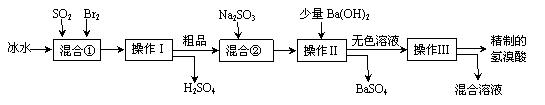
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为 。
33.(16分)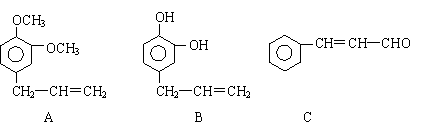 从某些植物树叶提取的挥发油中含有下列主要成分:
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)有关A、B、C三种物质的说法正确的是 (填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为 。
 (3)0.5molB与足量的溴水充分反应,消耗
mol单质溴。
(3)0.5molB与足量的溴水充分反应,消耗
mol单质溴。
(4)已知: 有机物C9H8O发生如下反应:

则C9H8O的结构简式为 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
34.(18分)
(1)(4分)如图,螺旋测微器甲和游标卡尺乙的读数分别为 mm, cm.

(2)(6分)在验证机械能守恒定律的实验中,与纸带相连的质量为1kg的重锤自由下落,打出的纸带如图所示,相邻记数点时间间隔为0.02s,,g取9.8m/s2.求:
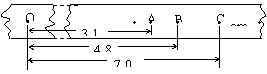
①打点计时器打下记数点B时,物体的速度VB= m/s(保留两位有效数字);
②某同学根据纸带上的O点到B点的数据,计算出物体的动能增加量△Ek=0.47J,重力势能减小量△Ep=0.48J,经过多次实验均发现△Ek略小于△Ep,试分析原因:
.
 (3)(8分)测量一个电阻Rx阻值(约为70Ω),给你如下器材:
(3)(8分)测量一个电阻Rx阻值(约为70Ω),给你如下器材:
A.电流表(50mA,内阻约10Ω)
B.电压表(0-3V-15V内阻分别是3KΩ和15KΩ)
C.电源(1.5V干电池2节)
D.滑动变阻器R1 (0-10Ω)
E.滑动变阻器R2(0-1kΩ)
F.电键、导线若干
根据所给定的器材和实验要求,画出了实验电路图如图所示,问:
①实验中电压表量程应选择 ,滑动变阻器应选择 (填“R1”或“R2”).
 ②根据电路图和选择的仪器连接好下面的实物线路图.
②根据电路图和选择的仪器连接好下面的实物线路图.
35、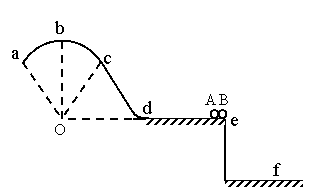 (18分)如图,竖直固定轨道abcd段光滑,长为L=1.0m的平台de段粗糙,abc段是以O为圆心的圆弧.小球A和B紧靠一起静止于e处,B的质量是A的4倍.两小球在内力作用下突然分离,A分离后向左始终沿轨道运动, 与de段的动摩擦因数μ=0.2,到b点时轨道对A的支持力等于A的重力的
(18分)如图,竖直固定轨道abcd段光滑,长为L=1.0m的平台de段粗糙,abc段是以O为圆心的圆弧.小球A和B紧靠一起静止于e处,B的质量是A的4倍.两小球在内力作用下突然分离,A分离后向左始终沿轨道运动, 与de段的动摩擦因数μ=0.2,到b点时轨道对A的支持力等于A的重力的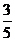 , B分离后平抛落到f点,f到平台边缘
, B分离后平抛落到f点,f到平台边缘
的水平距离S= 0.4m,平台高h=0.8m,g取10m/s2,求:
(1)(8分)AB分离时B的速度大小vB;
(2)(5分)A到达d点时的速度大小vd;
(3)(5分)圆弧 abc的半径R.
36、(18分)如图,带电量为+q、质量为m的粒子(不计重力)由静止开始经
A、B间电场加速后,沿中心线匀速射入带电金属板C、D间,后粒子由小孔
M沿径向射入一半径为R的绝缘筒,已知C、D间电压为U0,板间距离为d,C、D间与绝缘筒内均有垂直于纸面向里的匀强磁场,磁感应强度分别为B0、B.
(1)(6分)求粒子在C、D间穿过时的速度v0;
(2)(6分)求A、B间的加速电压U;
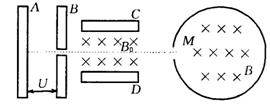 (3)(6分)粒子与绝缘筒壁碰撞,速率、电荷量都不变,为使粒子在筒内能与筒壁碰撞4次(不含从M孔出来的一次)后又从M孔飞出,求筒内磁感应强度B (用三角函数表示).
(3)(6分)粒子与绝缘筒壁碰撞,速率、电荷量都不变,为使粒子在筒内能与筒壁碰撞4次(不含从M孔出来的一次)后又从M孔飞出,求筒内磁感应强度B (用三角函数表示).
珠海市2010年9月高三摸底考试
理科综合答案及评分标准
第Ⅰ卷 选择题(共25小题,满分118分)
(四)计算:样品中铜的质量分数=__________________(用含W、m1.m2的代数式表示)
(三)实验内容:
在答题卡上按完成下表空白处内容
|
步骤 |
实验过程 |
实验现象 |
有关化学方程式 |
|
1 |
|
 |
 |
|
2 |
在C中加入样品W克,D中装入碱石 灰后并称量为m1克。连接好仪器,打开A的活塞,慢慢加溶液。 |
|
|
|
3 |
对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: |
|
|
|
4 |
冷却后,称量D的质量为m2克。 |
 |
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com