
4.接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是( )
①尾气用氨水处理 ②污水用石灰乳处理
③废渣用来造水泥、炼铁 ④设置“废热”锅炉产生蒸气,供热或发电。
A.只有①② B.只有①③④ C.只有①②③ D.全部
3.下列试剂的贮存方法错误的是 ( )
A.苯用带橡胶塞的试剂瓶贮存 B.浓硝酸存放在棕色试剂瓶中
C.少量白磷存放在水中 D.少量金属钠存放在煤油中
2.下列家庭小实验不合理的是 ( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
1.科学家最近又发现了一种新能源--“可燃冰”它的主要成分是甲烷与水分子的结晶水合物(CH4·nH20)。其形成:埋于海底地层深处的大量有机质在缺氧环境中,厌氧性细菌把有机质分解,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。又知甲烷同CO2一样也是温室气体。这种可燃冰的晶体类型是 ( )
A.离子晶体 B.分子晶体
C.原子晶体 D.金属晶体
28.如图所示实验室制取酚醛树脂的装置:
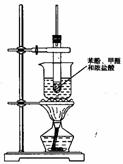 (1)试管上方长玻璃管的作用是
。
(1)试管上方长玻璃管的作用是
。
(2)浓盐酸在该反应的作用是: 。
(3)此反应需水浴加热,为什么不用温度计控制水浴温度?
。
(4)生成的酚醛树脂为 色 态。
(5)实验完毕后,若试管用水不易洗净,可以加入少量
浸泡几分钟后,然后洗净。
(6)写出实验室制取酚醛树脂的化学方程式(有机物用结构简式):
,此反应类型是 。
①此反应的装置与 的制取装置相似,惟一的区别在于 。
②制取酚醛树脂的反应物都为无色,但制出的酚醛树脂往往呈粉红色,原因: 。
③制得的酚醛树脂有 型和 型。
[参考答案]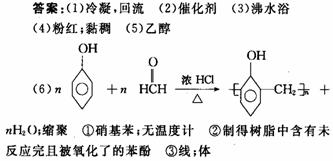
要点10.重要反应
(1)卤代烃(2个):
①CH3CH2Br在KOH的水溶液中加热
②CH3CH2Br在KOH的醇溶液中加热
(2)醇(6个)
①乙醇与金属钠反应
②乙醇与氢溴酸反应
③乙醇的消去反应
④乙醇的分子间脱水成醚反应
⑤乙醇的催化氧化
⑥乙醇与乙酸的酯化反应
(3)苯酚(2个反应式一个现象)
①苯酚与NaOH反应
②苯酚与浓溴水反应
③苯酚与FeCl3溶液反应
(4)醛(3个)
①乙醛的加氢还原反应
②乙醛的银镜反应
③乙醛与新制的氢氧化铜悬浊液反应
(5)酮(1个)
①丙酮的加氢还原反应
(6)羧酸(2个)
①乙酸与碳酸钙反应
②乙酸与乙醇的酯化反应
(7)酯(1个)
①乙酸乙酯的水解反应(碱性)
27.将煤焦油中的苯、甲苯和苯酚进行分离,可采用如下图所示方法和操作:
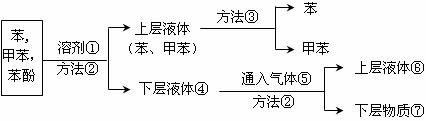
(1)写出物质①和⑤的分子式: ① ⑤ 。
(2)写出分离方法②和③的名称: ② ③ 。
(3)混合物加入溶液①反应的化学方程式:
。
(4)下层液体④通入气体⑤反应的化学方程式。
。
(5)分离出的苯酚含在 中。
[参考答案](1)NaOH、CO2 (2)分液、蒸馏
(3)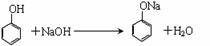 (4)
(4)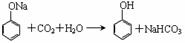 (5)⑦
(5)⑦
Ⅷ.酚醛树脂的制取
26.为了确定CH3COOH、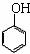 及H2CO3的酸性强弱,
及H2CO3的酸性强弱,
有人设计了如图所示的装置进行实验:
(1)若锥形瓶中装有适量易溶于水的正盐固体,则A中发生反应的离子方程式为:
。
(2)装置B中盛放的试剂是 ,它的作用是 。
(3)实验中观察到C中出现的主要现象是 。
[参考答案](1)2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O
(2)饱和NaHCO3溶液 除去CO2中混有的CH3COOH
(3)C中溶液变浑浊
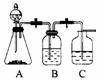
Ⅶ.含酚废水的处理
25. (2006·全国卷Ⅱ)可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
(2006·全国卷Ⅱ)可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入 顺序用操作是 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措 施是 。
(3)实验中加热试管a的目的是:
① ;
② 。
(4)试管b中加有饱和Na2CO3溶液,其作用是 。
(5)反应结束后,振荡试管b,静置。观察到的现象是 。
[参考答案](1)先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 (2)在试管a中加入几粒沸石(或碎瓷片) (3)①加快反应速率 ②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动 (4)吸收随乙酸乙酯蒸出的少量酸性物质和乙醇 (5)b中的液体分层,上层是透明的油状液体
 Ⅵ.比较酸性强弱的实验设计
Ⅵ.比较酸性强弱的实验设计
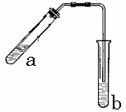
24.实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:

已知反应物的用量:0.3 mol NaBr(s);0.25 mol乙醇;36 mL浓硫酸(溶质质量分数为98%,密度为1.84 g·mL);25 mL水,其中乙醇的密度为0.80 g·mL-1。回答下列问题:
(1)该实验应选择下图中的 (填“a”或“b”)装置。
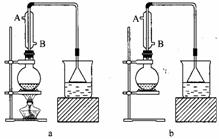
(2)反应装置中的烧瓶应选择下列哪种规格最合适 ( )
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是 ( )
A.A进B出 B.B进A出 C.从A进或B进均可
(4)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有 。
(5)用棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是 ,必须使用的仪器是 。
(6)本实验的产率为60%,则可制取溴乙烷 g。
(7)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品--溴乙烷中含有溴元素,可采取的实验方法是 。
[参考答案](1)a(2)C(3)A(4)C2H5Br、C2H5OC2H5和Br2(5)NaOH溶液 分液漏斗 (6)16.35
(7)将C2H5Br和稀NaOH溶液共热完全反应后,再用稀HNO3酸化,加入AgNO3溶液,若生成浅黄色沉淀,证明溴乙烷中含有溴元素
[解析](1)解答本题的关键是制备溴乙烷装置的选择,制备溴乙烷需加热,故a装置正确。
(2)选择反应容器烧瓶规格的原则是反应物体积应介于烧瓶容积的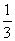 至
至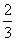 之间为宜。O.25 mol乙醇的体积为
之间为宜。O.25 mol乙醇的体积为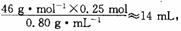 三种液体混合后,不考虑混合时液体体积的变化,V(总)=36 mL+25 mL+14 mL=75mL,故应选择150
mL的圆底烧瓶。
三种液体混合后,不考虑混合时液体体积的变化,V(总)=36 mL+25 mL+14 mL=75mL,故应选择150
mL的圆底烧瓶。
(3)冷凝管中冷凝水的流向与内管中气体的流向相反,即A进B出。
(4)可能发生的副反应有:
①乙醇与浓H2SO4在170℃时脱水生成乙烯;②乙醇与浓H2SO4在140℃时分子间脱水生成乙醚;③浓H2SO4有强氧化性,能将Br-氧化成Br2。由于副反应的发生,使得溴乙烷中混有乙醚、溴等杂质。
(5)粗溴乙烷中因溶有溴而显黄色,洗去黄色的方法是用NaOH溶液洗涤,并用分液漏斗分液。
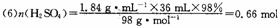
由反应方程式: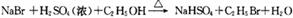
知理论上生成C2H5Br O.25mol,因本实验的产率为60%,故实际可制得的溴乙烷为:
O.25 mol×109 g·mol-1×60%=16.35 g
(7)确定卤代烃中含卤素原子的方法是:将卤代烃和NaOH溶液混合共热,所得产物用HNO3酸化后,加入AgNO3溶液,若有浅黄色沉淀生成,则证明含有溴元素。
Ⅴ.乙酸乙酯的制取
23.实验室制取乙烯的过程中,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题。
(1)图中①、②、③、④装置可盛放的试剂是:① ;② ;③ ;
④ (将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是 ;
(3)使用装置②的目的是 ;
(4)使用装置③的目的是 ;
(5)确定含有乙烯的现象是 。
[参考答案]
Ⅳ.乙醇与氢卤酸反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com