
9.(08年海南化学·9)下列离子方程式中,属于水解反应的是C
A.HCOOH+H2O HCOO-
+ H3O+
HCOO-
+ H3O+
B.CO2+H2O HCO3-
+ H+
HCO3-
+ H+
C.CO32-
+ H2O HCO3- + OH-
HCO3- + OH-
D.HS- +
H2O S2-
+ H3O+
S2-
+ H3O+
答案:C
解析:选项A、B、D表示的都是电离。
3.HCl与HAc均反应完后,继续滴加NH3·H2O弱电解质,电导率变化不大,因为溶液被稀释,有下降趋势。
综上所述:答案选D。
2.当HCl被中和完后,继续与HAc弱电解质反应,生成NH4Ac的强电解质,所以电导率增大。
8. (08年广东化学·18)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是D
(08年广东化学·18)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是D

答案:D
解析:1.HCl为强电解质,HAc为弱电解质,滴加NH3·H2O弱电解质先与HCl反应,生成同样为强电解质的NH4Cl,但溶液体积不断增大,溶液稀释,所以电导率下降。
7.(08年广东化学·17)盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是C
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
答案:C
解析:A中,生成Na2CO3溶液,CO32-会发生水解,生成HCO3-,所以A错;
电荷守恒 :C(H+)+C(Na+)=C(HCO3-)+2C(CO32-)+C(OH-)
物料守恒:C(Na+)=C(HCO3-)+ C(CO32-)+C(H2CO3)
两式相减得 :C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 所以B错误。
C中,生成NaAc,Ac-水解呈碱性,故C正确;相同PH,相同体积的HCl和HAc,因为HAc为弱酸,所以HAc的物质的量浓度大,HAc所消耗的NaOH的物质的量多,D错。
6. (08年广东化学·9)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO32-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO32-浓度随时间变化关系的是B
(08年广东化学·9)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO32-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO32-浓度随时间变化关系的是B
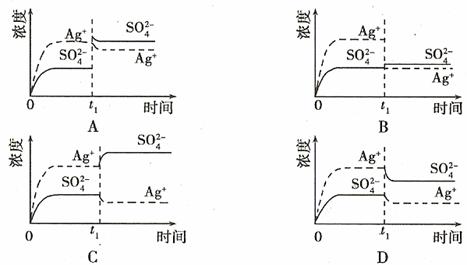
答案:B
解析:Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol·L-1,所以c(SO42-)=0.017mol·L-1;当加入100ml 0.020mol·L-1Na2SO4溶液后,c(SO42-)=0.0185mol·L-1,c(Ag+)=0.017mol·L-1(此时Q<Ksp)。由计算可知选B。
5.(2007海南·08)下列溶液能与镁反应生成氢气的是( )
A.氯化铵溶液 B.氢氧化钠溶液 C.碳酸钾溶液 D.饱和石灰水
答案:A
考点:本题考查了盐的水解规律。
解析:氯化铵是强酸弱碱盐,水解,显酸性。相当于发生Mg+2H+=Mg2++H2↑ ,而其他溶液均显碱性。所以选A。
4.(2007海南·)下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
答案:C
考点:本题考查了电离平衡移动以及酸碱中和后溶液pH的变化规律。
解析:水的电离与温度有关,温度越高,电离度越大,但[H+]=[OH-]水仍呈中性,A错;我们知道pH每升高一个单位,对于强酸需要稀释10倍,而对于弱酸稀释的倍数超过了10倍,B中由于醋酸为弱酸,稀释至原来的10倍后,pH<4,B错;在D中,当酸与碱的pH之和等于14时,等体积混合后,谁弱显谁性,即pH<7,D错。
3.(07年广东化学·15)下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
答案:AD
解析:溶液中离子浓度大小比较要综合运用电离平衡,盐类水解知识,要记住三个守恒:电荷守恒、物料守恒、质子守恒。A根据质子守恒,水电离出的H+和OH-的物质的量相等,Na2CO3溶液中H+分别以HCO3-、H+、H2CO3形式存在,故A对,B中由于NH4+水解,c(NH4+与c(Cl-)不等,B错,C中根据电荷守恒有:c(Na+)+ c(H+)==c(OH-)+ c(CH3COO-),因为c(H+)>c(OH-),故c(CH3COO-)>c(Na+),C错。D中Na+、NO3-不水解加入稀盐酸后二者的物质的量浓度比仍是1:1,故D对。
2.(07年山东理综·14)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.在通入少量氯气, 减小
减小
B.通入少量SO2,溶液的漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
答案:D
解析:在氯水中存在如下平衡:Cl2+H2O HCl+HClO、H2O
HCl+HClO、H2O H++OH-、HClO
H++OH-、HClO H++ClO-。A中在通入少量氯气,平衡右移,生成的次氯酸和盐酸增多,氢离子浓度增大有两个方面原因,次氯酸浓度增大和盐酸完全电离,而次氯酸根的增大只受次氯酸浓度增大的影响,故该值增大,错误;B中通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,漂白性减弱,错误;C中加入少量固体氢氧化钠反应后的溶液仍是电中性的,但酸碱性不为中性,应为弱酸性。溶液中阴阳离子所带正负电荷总数相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),但是c(H+)应该大于c(OH-),故此等式不成立,错误;D中加水,即稀释氯水溶液的酸性减弱,即c(H+)减小,所以水的电离平衡向正向移动,正确。
H++ClO-。A中在通入少量氯气,平衡右移,生成的次氯酸和盐酸增多,氢离子浓度增大有两个方面原因,次氯酸浓度增大和盐酸完全电离,而次氯酸根的增大只受次氯酸浓度增大的影响,故该值增大,错误;B中通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,漂白性减弱,错误;C中加入少量固体氢氧化钠反应后的溶液仍是电中性的,但酸碱性不为中性,应为弱酸性。溶液中阴阳离子所带正负电荷总数相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),但是c(H+)应该大于c(OH-),故此等式不成立,错误;D中加水,即稀释氯水溶液的酸性减弱,即c(H+)减小,所以水的电离平衡向正向移动,正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com