
每小题都给出代号为A、B、C、D的四个选项,其中只有一个是正确的,请把正确选项的代号写在题后的括号内。每一小题,选对得4分,不选、选错或选出的代号超过一个的(不论是否写在括号内)一律得0分。
1.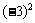 的值是……………………………………………………………………………………………[ ]
的值是……………………………………………………………………………………………[ ]
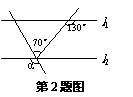 A.9 B.-9 C.6 D.-6
A.9 B.-9 C.6 D.-6
5. 城市:Sydney有许多名胜,如悉尼歌剧院(opera house)。摘自高考英语网
Australia lies on the west of the Pacific. It covers an area of 7.6 million square kilometers . It has a small population of over 10 million. Most of them live in the east of the country by the sea. Canberra, the capital of Australia, is a beautiful city. Sydney is one of the biggest cities in Australia. It has many places of interest. The Opera House is famous throughout the world.
4. 首都:Canberra, 风景秀丽;
3. 人口:1,000多万,多数人住在东部沿海地区;
2. 面积:760万平方公里
1. 位置:太平洋的西侧
30、 (1)某温度(t℃)时,测得0.01 mol·L-1 的NaOH溶液的pH=13,请回答下列问题:
(1)某温度(t℃)时,测得0.01 mol·L-1 的NaOH溶液的pH=13,请回答下列问题:
 ①该温度下水的Kw=
。
①该温度下水的Kw=
。
 ②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
 (2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为
.
(2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为
.





























 瑞安中学2008学年第二学期高二年级期末考试
瑞安中学2008学年第二学期高二年级期末考试
29、 (10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:
(10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:
 2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):
2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):
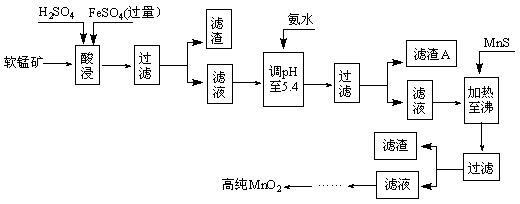










 某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
|
沉淀物 |
CuS |
ZnS |
MnS |
FeS |
|
|
|
Ksp |
8.5×10-45 |
1.2×10-23 |
1.4×10-15 |
3.7×10-14 |
|
|
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为:
 。
。
 (2)滤渣A的主要成分为
。
(2)滤渣A的主要成分为
。
 (3)加入MnS的目的是除去
杂质。
(3)加入MnS的目的是除去
杂质。
 (4)碱性锌锰电池中,MnO2参与的电极反应式为
。
(4)碱性锌锰电池中,MnO2参与的电极反应式为
。
 (5)从废旧碱性锌锰电池中可回收利用的物质有
(写两种)。
(5)从废旧碱性锌锰电池中可回收利用的物质有
(写两种)。
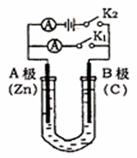
28、 (15分)如右图所示,常温,U形管内盛有100mL的某种溶液,
(15分)如右图所示,常温,U形管内盛有100mL的某种溶液,
 请按要求回答下列问题。
请按要求回答下列问题。
 (1)若所盛溶液为CuSO4溶液,打开K2,合并K1,则:
(1)若所盛溶液为CuSO4溶液,打开K2,合并K1,则:
 ① A为 极,B极的电极反应式为
。
① A为 极,B极的电极反应式为
。
 ②反应过程中,溶液中SO42-和OH-离子向 极(填:A或B)
②反应过程中,溶液中SO42-和OH-离子向 极(填:A或B)
 移动。
移动。
 (2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,合并K2,则:
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,合并K2,则:
 ①A电极可观察到的现象是
。
①A电极可观察到的现象是
。
 ②电解过程总反应的化学方程式是
。
②电解过程总反应的化学方程式是
。
 ③反应一段时间后打开K2 ,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,将溶液充分混合,溶液的pH为 。
③反应一段时间后打开K2 ,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,将溶液充分混合,溶液的pH为 。
 ④向电解后的电解质溶液中加入或通入 (填试剂名称),能使溶液复原。
④向电解后的电解质溶液中加入或通入 (填试剂名称),能使溶液复原。
27、 (8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
(8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
 ①用0.1000mol/L的标准盐酸润洗酸式滴定管2-3次
①用0.1000mol/L的标准盐酸润洗酸式滴定管2-3次

 ②取标准盐酸注入酸式滴定管至“0”刻度以上2-3mL处
②取标准盐酸注入酸式滴定管至“0”刻度以上2-3mL处
 ③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
 ④调节液面至“0”或“0”刻度以下,记下读数
④调节液面至“0”或“0”刻度以下,记下读数
 ⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2-3滴甲基橙试液
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2-3滴甲基橙试液
 ⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
 请回答下列问题:
请回答下列问题:
 (1)判断到达滴定终点的现象是
。
(1)判断到达滴定终点的现象是
。
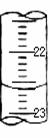
 (2)某次滴定时的滴定管中的液面如右图所示,其读数为 mL。
(2)某次滴定时的滴定管中的液面如右图所示,其读数为 mL。
 (3)根据下列数据:
(3)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.50 |
25.40 |
|
第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 mol/L。
 (4)下列实验操作会使实验结果偏高的是
。
(4)下列实验操作会使实验结果偏高的是
。
 A、锥形瓶用待测液润洗后再注入待测液
A、锥形瓶用待测液润洗后再注入待测液
 B、酸式滴定管未用标准液润洗,便装入标准液
B、酸式滴定管未用标准液润洗,便装入标准液

 C、酸式滴定管滴定前俯视读数,滴定后仰视读数
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
 D、酸式滴定管滴定前有气泡,滴定后无气泡
D、酸式滴定管滴定前有气泡,滴定后无气泡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com