
1.掌握描述物理量的三种基本方法(文字法、公式法、图象法)。
3.理解交变电流的瞬时值和最大值及中性面的准确含义。
2.掌握交变电流的变化规律及表示方法。
1.使学生理解交变电流的产生原理,知道什么是中性面。
20. 1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑: (1) C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;(2) C60分子只含有五边形;(3)多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数 = 2。据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。请回答下列问题:
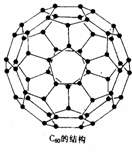
(1)固体C60与金刚石相比较,熔点较高者应是_____,理由是:________。
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)___________,并简述其理由:_______________________________。
(3)通过计算,确定C60分子所含单键数。
(4)C70分子也制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形的数目。
19. 有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______。
(2)B的氢化物的电子式为______,属______分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为____,属___分子,其晶体类型是_ ,俗名______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)______。
(5)C和D的化合物溶于水后滴入过量KOH,现象是______,离子方程式______。
18. 下图为高温超导领域里的一种化合物--钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。
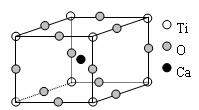
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有 、 个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是 。该物质的化学式可表示为 。
(3)若钙、钛、氧三元素的相对质量分别为a,b,c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为 g/cm3。
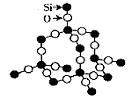
17. 二氧化硅晶体是立体的网状结构。其晶体模型如下图所示。认真观察晶体模型并回答下列问题:
(1)二氧化硅晶体中最小的环为 元环。
(2)每个硅原子为 个最小环共有。
(3)每个最小环平均拥有 个氧原子。
16. 在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有___(填数字)个碳原子,每个碳原子上的任意两个C-C键的夹角都是_____(填角度)。
15. 石墨是层状晶体,每一层内碳原子排列成正六边形,一个个正六边形排列成平面的网状结构。如果将每对相邻的原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与碳碳化学键数之比是( )
A. 1∶1 B. 1∶2 C. 1∶3 D. 2∶3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com