
4. 平衡转化率:对于可逆反应aA+bB cC+dD,反应物A的平衡转化率可以表示为:
平衡转化率:对于可逆反应aA+bB cC+dD,反应物A的平衡转化率可以表示为:
α(A)==(c0(A)- [A])/c0(A)×100%
3.化学平衡常数:
 (1)概念:对于一定条件下的可逆反应(aA+bB cC+dD),达到化学平衡时,生成物浓度的乘幂的乘积与反应物浓度的乘幂的乘积之比为一常数,记作Kc,称为化学平衡常数(浓度平衡常数)。
(1)概念:对于一定条件下的可逆反应(aA+bB cC+dD),达到化学平衡时,生成物浓度的乘幂的乘积与反应物浓度的乘幂的乘积之比为一常数,记作Kc,称为化学平衡常数(浓度平衡常数)。
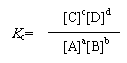 (2)数学表达式:
(2)数学表达式:
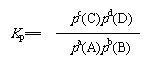 如果反应物和生成物均为气体,当达到化学平衡时,将由各物质平衡分压算得的平衡常数称为压强平衡常数。即
如果反应物和生成物均为气体,当达到化学平衡时,将由各物质平衡分压算得的平衡常数称为压强平衡常数。即
浓度平衡常数和压强平衡常数均称为化学平衡常数。
(3)意义:平衡常数的大小化学反应可能进行的程度(即反应限度);平衡常数的数值越大,说明反应进行得越完全。
(4)影响因素:只与温度有关,而与浓度无关。
2.化学平衡(状态):
(1)概念:在一定条件下可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,这种状态称为化学平衡状态,简称化学平衡。
(2)特征:
①逆:化学平衡研究的对象是可逆反应。
②等:V(正)==V(逆)≠0
③动:化学平衡是动态平衡。虽然V(正)==V(逆),但正、逆反应仍在进行。
④定:反应物和生成物的浓度保持一定。
⑤变:外界条件改变,平衡也随之改变。
1. 可逆反应:在相同条件下同时向正、反两个方向进行的反应称为可逆反应。在可逆反应中使用“
”。
可逆反应:在相同条件下同时向正、反两个方向进行的反应称为可逆反应。在可逆反应中使用“
”。
4.第Ⅳ象限符号为“-、+”(△S<0、△H>0)时化学反应的方向--所有温度下反应均不能自发进行
[例4]CO(g)=C(s,石墨)+1/2O2(g),其△H=110.5 kJ·mol-1△S== -89.36J·mol-1·K-1,试判断该反应在298K和2000K时反应是否自发进行?
[解析]
298K时,△H-T△S=110.5 kJ·mol-1-298K×10-3×(-89.36kJ·mol-1·K-1) ==137.13 kJ·mol-1>0,故298K时反应不能自发进行。
2000K时,△H-T△S=110.5 kJ·mol-1-2000K×10-3×(-89.36kJ·mol-1·K-1) ==289.22 kJ·mol-1>0,故2000K时,反应也不能自发进行。
事实上,△S<0、△H>0时,仅从符号上进行分析,无论温度如何变化,恒有△H-T△S>0,故化学反应的方向--所有温度下反应均不能自发进行。
从以上四个象限的情况来看,交叉象限的情况相反相成,第Ⅰ象限(高温下反应自发进行)和第Ⅲ象限(低温下反应自发进行)相反相成,第Ⅱ象限(所有温度下均可自发进行)和第Ⅳ象限(所有温度下反应均不能自发进行)相反相成。分析化学反应的方向的热力学判据是△H-T△S<0,而这个判据是温度、压强一定的条件下反应自发进行的趋势,并不能说明反应能否实际发生,因为反应能否实际发生还涉及动力学问题。
|

第3课时 化学反应的限度
3.第Ⅲ象限符号为“-、-”(△S<0、△H<0)时化学反应的方向--低温下反应可以自发进行
[例3]常温下氢氧化亚铁与空气中的氧气及水有可能发生反应,即:
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s),已知该反应在298K时的△H== -444.3 kJ·mol-1,△S== -280.1 J·mol-1·K-1
试问该反应在常温下是否自发进行?
[解析]
根据△H-T△S=-444.3 kJ·mol-1-298K×10-3×(-280.1 kJ·mol-1·K-1)== -360.83 kJ·mol-1<0,故298K时反应可自发进行。
由于焓变和熵变的作用相反,且二者相差悬殊,焓变对反应的方向起决定性作用,故反应可自发进行。
假定温度达到2000K,则△H-T△S=-444.3 kJ·mol-1-2000K×10-3×(-280.1 kJ·mol-1·K-1)=115.9 kJ·mol-1>0,反应不能自发行。即高温下反应不能自发进行。
2.第Ⅱ象限符号为“+、-”(△S>0、△H<0)时化学反应的方向--所有温度下反应均能自发进行
[例2]已知双氧水、水在298K、100kPa时的标准摩尔生成焓的数据如下:
|
物 质 |
△fH /kJ·mol-1 /kJ·mol-1 |
|
H2O(l) |
-258.8 |
|
H2O2(l) |
-191.2 |
|
O2(g) |
0 |
(1)试由以上数据计算双氧水发生分解反应的热效应。
(2)若双氧水发生分解反应生成液态水和氧气时,其△S==57.16J·mol-1·K-1
试判断该反应在常温下能否自发进行。若温度达到2000K时,反应能否自发进行。
[解析]
(1)根据△H ==H(产物)-H(反应物)得,△H ==2×(-258.8kJ·mol-1)+0-2×(-191.2kJ·mol-1)=== -135.2kJ·mol-1。
(2)在298K时,△H-T△S=-135.2kJ·mol-1-(298K×10-3×57.16kJ·mol-1·K-1) == -152.23 kJ·mol-1<0
∴该反应在常温下可自发进行。
温度达到2000K,且假定焓变和熵变不随温度变化而变化,△H-T△S=-135.2kJ·mol-1-(2000K×10-3×57.16kJ·mol-1·K-1)== -249.52kJ·mol-1<0
故△S>0、△H<0时,仅从符号上进行分析,无论温度如何变化,恒有△H-T△S<0,故化学反应的方向--所有温度下反应均能自发进行。
1.第Ⅰ象限符号为“+、+”(△S>0、△H>0)时化学反应的方向--高温下反应自发进行
[例1]石灰石的分解反应为:CaCO3(s)==CaO(s) +CO2(g)
其△H(298K)==178.2kJ·mol-1,△S(298K)== 169.6J·mol-1·K-1
169.6J·mol-1·K-1
试根据以上数据判断该反应在常温下是否自发进行?其分解温度是多少?
[解析]
∵△H-T△S=178.2kJ·mol-1-298K×10×-3×169.6kJ·mol-1·K-1
==128kJ·mol-1>0
∴298K时,反应不能自发进行。即常温下该反应不能自发进行。
由于该反应是吸热的熵增加反应,升高温度可使△H-T△S<0,假设反应焓变和熵变不随温度变化而变化,据△H-T△S<0可知,T>△H/△S ==178.2kJ·mol-1/10×-3×169.6kJ·mol-1·K-1==1051K,即温度高于778℃时反应可自发进行。
4.焓变和熵变对反应方向的共同影响--“四象限法”判断化学反应的方向。
在二维平面内建立坐标系,第Ⅰ象限的符号为“+、+”,第Ⅱ象限的符号为“+、-”,第Ⅲ象限的符号为“-、-”,第Ⅳ象限的符号为“-、+”。借肋于数学坐标系四个象限的符号,联系焓变与熵变对反应方向的共同影响,可以从热力学的角度快速判断化学反应的方向。
在温度、压强一定的条件下,化学反应的方向的判据为:
△H-T△S<0 反应能自发进行
△H-T△S==0反应达到平衡状态
△H-T△S>0反应不能自发进行
 反应放热和熵增加都有利于反应自发进行。该判据指出的是化学反应自发进行的趋势。
反应放热和熵增加都有利于反应自发进行。该判据指出的是化学反应自发进行的趋势。
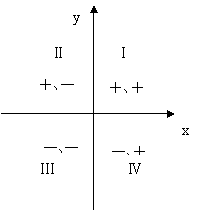
|

2.反应熵变与反应方向
(1)熵:描述大量粒子混乱度的物理量,符号为S,单位J·mol-1·K-1,熵值越大,体系的混乱度越大。
(2)化学反应的熵变(△S):反应产物的总熵与反应物总熵之差。
(3)反应熵变与反应方向的关系
①多数熵增加的反应在常温常压下均可自发进行。产生气体的反应、气体物质的量增加的反应,熵变都是正值,为熵增加反应。
②有些熵增加的反应在常温下不能自发进行,但在较高温度下则可自发进行。如碳酸钙的分解。
③个别熵减少的反应,在一定条件下也可自发进行。如铝热反应的△S== -133.8 J·mol-1·K-1,在点燃的条件下即可自发进行。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com