
22. ---Are all telephone numbers_______ in the directory? --- Yes, all ________ Jane’s.
A. listed; including B. listed; included
C. including; includes D. being listed; being included
第一节、单项选择(15分)
21._____ we were worried about was _______ they could manage to control the pollution.
A. That; how B. That; whether C. What; that D. What; whether
28、某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
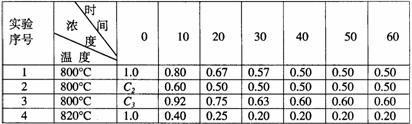
根据上述数据,完成下列填空:
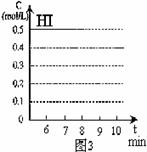
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
27.Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ 2Fe2++I2(水溶液)。
(1)在一定温度下,测得2min内生成I2的浓度为0.02mol/L,则用Fe3+表示该反应在这2min内平均反应速率为________________。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K{c(I-)}m{c(Fe3+)}n(K为常数)
2Fe2++I2(水溶液)。
(1)在一定温度下,测得2min内生成I2的浓度为0.02mol/L,则用Fe3+表示该反应在这2min内平均反应速率为________________。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K{c(I-)}m{c(Fe3+)}n(K为常数)
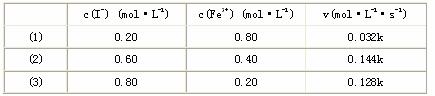
通过所给的数据计算得:在v=K{c(I-)}m{c(Fe3+)}n中。m、n的值为________________[选填(A)、(B)、(C)、(D)。 A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2 I-浓度对反应速率的影响________________Fe3+浓度对反应速率的影响。(选填:小于、大于、等于)
26、热力学是专门研究能量相互转变过程中所遵循的法则的一门科学。在热力学研究中,为了明确研究的对象,人为地将所注意的一部分物质或空间与其余的物质或空间分开。被划分出来作为研究对象的这一部分称之为体系;而体系以外的其他部分则称之为环境。热化学方程式中的H实际上是热力学中的一个物理量,叫做焓,在化学上表示一个封闭体系中化学反应的能量和对环境所作的功的和。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以 的形式体现的。对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH 0。(填“大于”、“小于”),该反应是 (填“放热”、“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3kPa、298K时,断开1mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g); ΔH=436 kJ·mol-1],形成化学键时:ΔH<0[如2H(g)=H2(g);ΔH=--436kJ·mol-1]。
已知: H2(g)+Cl2(g)=2HCl(g); ΔH=-185kJ·mol-1
ΔH298(H2)=436 kJ·mol-1 ,ΔH298(Cl2)=247 kJ·mol-1
则ΔH298(HCl)= 。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应
的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g); ΔH=-25kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g); ΔH=-47kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g); ΔH=19kJ·mol-1
请写出CO还原FeO的热化学方程式: ;
25.将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(s)+dD。当反应进行一定时间后,测得A减少了nmol,B减少了
cC(s)+dD。当反应进行一定时间后,测得A减少了nmol,B减少了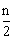 mol,C增加了
mol,C增加了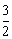 nmol,D增加了nmol,此时达到化学平衡。
(1)该化学方程式中各物质的化学计量数为:a=_____________,b=_____________,c=_____________,d=_____________。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态为:A____________,B____________,D____________。
(3)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为________________(填“放热”或“吸热”)反应。
nmol,D增加了nmol,此时达到化学平衡。
(1)该化学方程式中各物质的化学计量数为:a=_____________,b=_____________,c=_____________,d=_____________。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态为:A____________,B____________,D____________。
(3)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为________________(填“放热”或“吸热”)反应。
24.在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定的条件下发生如下反应:
H2(g)+I2(g)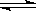 2HI(g);△H<0
2HI(g);△H<0
反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 ;
(2)根据图1数据,反应开始至达到平衡时,平均速率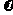 (HI)为
;
(HI)为
;
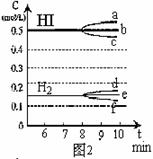
(3)反应达到平衡后,第8分钟时:① 若升高温度,化学平衡常数K(填写增大、减小或不变)HI浓度的变化正确 ;(用图2中a-c的编号回答)② 若加入I2,H2浓度的变化正确的是 。(用图2中d-f的编号回答)
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。

23.在一定条件卞,二氧化硫和氧气发生如下反应:
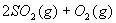
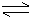
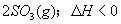
(1)写出该反应的化学平衡常数表达式K=_____________________________________。
(2)降低温度,该反应K值____________,二氧化硫转化率_____________,化学反应速度____________(以上均填“增大”、“减小”或“不变”)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________。
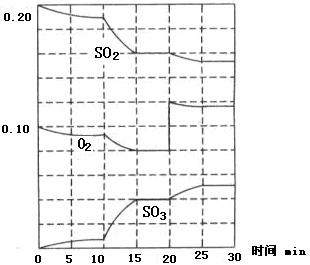
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是__________(用文字表达)。 10 min到15 min的曲线变化的原因可能是_________(填写编号)。 a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com