
3.情感、态度价值观
(1)领略物理思维方法在探究、分析推理过程中的作用。
(2)由日常生活中的气体等容变化现象养成观察身边的物理现象的习惯。
(3)在探究过程中体验合作的意义和乐趣,养成共享各自的探究成果的习惯。
2.过程与方法
(1)运用控制变量的方法进行DIS实验。
(2)运用外推法建立热力学温标,并在对p-T图像分析的基础上得出查理定律。
1.知识与技能
(1)知道一定量的气体在体积不变的情况下压强和温度间关系的图象表达,即p-t图像和p-T图像。
(2)知道热力学温标,知道绝对零度的物理意义。
(3)理解查理定律。
(4)学会用DIS实验器材完成一定量的气体在体积不变的情况下压强和温度间关系的
探究任务,并正确处理实验数据。
本节内容是学生在学习了分子动理论和波意耳定律等知识后,对气体状态变化规律的研究过程和方法有一定了解的基础上,进一步研究气体的等容变化过程及其规律。从科学研究方法来看,热学作为一个独立的知识体系,它在继承力学的许多研究方法的同时,又增添一些新的研究方法--外推法(也称极限思维法),并导致热力学温标的创立;建立微观气体模型对宏观规律获得本质的认识等。
学习本节内容需要理解气体的体积、压强和温度这三个状态参量和气体的状态变化之物理意义,并且要了解探究气体状态变化规律常用的方法--控制变量法和使用DIS实验器材的一些必备技能。
通过气球加热后破裂等情景引入,使学生定性认识到一定质量的气体在体积不变时其压强变化与温度变化的趋向相同。
通过对不同种类、不同体积的气体进行DIS实验探究,在计算机上得到p-t图像,并要求学生作图,然后通过对p-t图像的分析、讨论,理解压强随温度变化是线性的关系和图线在纵轴与横轴上截距的物理意义。
应用外推法合理外推图线,创建热力学温标,并得到查理定律。
本节课的学习体现出以学生为学习的主体,在获得知识的同时,感受科学探究的过程与方法,学会应用DIS实验研究实际问题,应用物理思维方法进行推理分析、得出结论,促使学生形成乐于探究的情感。
(三)分子晶体
1、定义:分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体。
(1)构成分子晶体的粒子是分子;
(2)分子晶体的粒子间的相互作用是范德华力;
(3)范德华力远小于化学键的作用;
(4)分子晶体熔化破坏的是分子间作用力。
2、典型的分子晶体
(1)所有非金属氢化物:H2O、H2S、NH3、CH4、HX
(2)部分非金属单质:X2、 N2、 O2、 H2、S8、P4、C60
(3)部分非金属氧化物:CO2、SO2、N2O4,P4O6, P4O10
(4)几乎所有的酸:H2SO4、HNO3、H3PO4
(5)大多数有机物:乙醇,冰醋酸,蔗糖
3、分子晶体的物理特性:
某些分子晶体的熔点
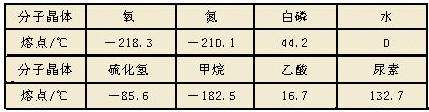
由于范德华力很弱,所以分子晶体一般具有:
(1)较低的熔点和沸点;
(2)较小的硬度;
(3)一般都是绝缘体,熔融状态也不导电。
[思考1]为何分子晶体的硬度小,熔沸点低?
因为构成晶体的微粒是分子,分子之间以分子间作用力(主要是范德华力)相结合,范德华力远小于化学键的作用。
[思考2]是不是在分子晶体中分子间只存在范德华力?
不对,分子间氢键也是一种分子间作用力,如冰中就同时存在着范德华力和氢键。
[思考3]为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。由于分子间作用力特别是氢键的方向性,导致晶体冰中有相当大的空隙,所以相同状况下体积较大。又由于CO2分子的相对分子质量>H2O分子的相对分子质量,所以干冰的密度大。
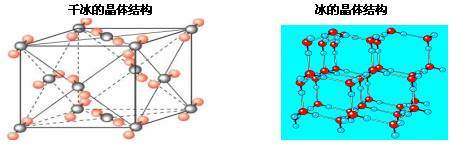
4、分子晶体的结构特征
|
|
组成微粒 |
微粒间作用 |
堆积方式 |
熔沸点比较 |
密度比较 |
|
冰 |
水分子 |
范德华力和氢键 |
每个分子周围有4个紧邻的分子 |
较高 |
较小 |
|
干冰 |
CO2分子 |
范德华力 |
每个分子周围有12个紧邻的分子 |
较低 |
较大 |
大多数分子晶体结构有如下特征:
(1)如果分子间作用力只是范德华力。以一个分子为中心,其周围通常可以有几个紧邻的分子。如O2、C60、CO2,我们把这一特征叫做分子紧密堆积。
(2)如果分子间除范德华力外还存在着氢键,分子就不会采取紧密堆积的方式。如在冰的晶体中,每个水分子周围只有4个紧邻的水分子,形成正四面体。氢键不是化学键,比共价键弱得多却跟共价键一样具有方向性,而氢键的存在迫使四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中空间利用率不高,皆有相当大的空隙使得冰的密度减小。
5、分子晶体熔、沸点高低的比较规律
分子晶体要熔化或汽化都需要克服分子间的作用力。分子间作用力越大,物质熔化和汽化时需要的能量就越多,物质的熔、沸点就越高。因此,比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范力和氢键)的大小。
(1)组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越高。如:O2>N2,HI>HBr>HCl。
(2)分子量相等或相近,极性分子的范德华力大,熔沸点高,如CO>N2
(3)含有氢键的,熔沸点较高。如H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
(4)在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。如沸点:正戊烷>异戊烷>新戊烷;芳香烃及其衍生物苯环上的同分异构体一般按照“邻位>间位>对位”的顺序。
(二)晶胞
1、晶胞的定义:晶体结构中的基本单元叫晶胞。
(1)晶胞是从晶体结构中截取出来的大小、形状完全相同的平行六面体。晶胞代表整个晶体,无数个晶胞堆积起来,则得到晶体。
(2)整个晶体是由晶胞“无隙(相邻晶胞之间没有任何间隙)并置(所有晶胞都是平行排列的,取向相同)”堆砌而成。晶胞的无隙并置体现了晶体的各向异性(强度、导热、光学性质)和紧密堆积(紧密堆积指由无方向性的金属键、离子键和范德华力等结合的晶体中,原子、离子或分子等微观粒子总是趋向于相互配位数高,能充分利用空间的堆积密度最大的那些结构。)。
(3)晶胞内微粒的组成反映整个晶体的组成,求出晶胞中微粒的个数比就能写出晶体的化学式。
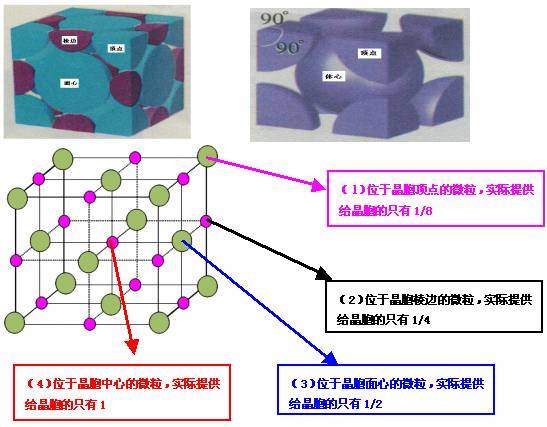
2、晶胞中原子个数的计算方法:
(一)晶体与非晶体
1、晶体的定义:晶体是由原子或原子团、离子或分子在空间按一定规律周期性地重复排列构成的固体物质。非晶体是原子、分子或离子无规则地堆积在一起所形成的固体。
(1)一种物质是否是晶体是由其内部结构决定的,而非由外观判断。
(2)晶体内部的原子有规律地排列,且外观为多面体,为固体物质。
(3)周期性是晶体结构最基本的特征。
2、晶体与非晶体的本质差异
|
|
自范性 |
微观结构 |
|
晶体 |
有(能自发呈现多面体外形) |
原子在三维空间里呈周期性有序排列 |
|
非晶体 |
没有(不能自发呈现多面体外形) |
原子排列相对无序 |
(1)自范性:晶体能自发性地呈现多面体外形的性质。
(2)晶体自范性的本质:是晶体中粒子微观空间里呈现周期性地有序排列的宏观表象。
(3)晶体自范性的条件之一:生长速率适当。如熔融态的二氧化硅,快速地冷却得到玛瑙,而缓慢冷却得到水晶。
3、晶体形成的一段途径:
(1)熔融态物质凝固。如从熔融态结晶出来硫晶体。
(2)气态物质冷却不经液态直接凝固(凝华)。如凝华得到的碘晶体。
(3)溶质从溶液中析出。如从硫酸铜饱和溶液中析出的硫酸铜晶体。
4、晶体的特点:
(1)均匀性
(2)各向异性
(3)自范性
(4)有明显确定的熔点
(5)有特定的对称性
(6)使X射线产生衍射
6. 了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
5. 掌握原子晶体的概念,能够区分原子晶体和分子晶体。
4. 理解分子间作用力和氢键对物质物理性质的影响,知道一些常见的属于分子晶体的物质类别。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com