
5.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。则二氧化氯( )
A.是强氧化剂 B. 是强还原剂
C.是离子化合物 D.分子中氯为负1价
4.对于司机酒后驾车,可对其呼出的气体进行检验而查出,所利用的化学反应如下:
2CrO3(红色) + 3C2H5OH+3H2SO4===Cr2(SO4)3(绿色) + 3CH3CHO +6H2O
 上述反应中的氧化剂是( )
上述反应中的氧化剂是( )
A.H2SO4 B.C2H5OH翰林汇 C.Cr2(SO4)3 D. CrO3
3.下列变化过程,属于还原反应的是( )
A. 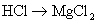 B.
B. 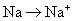
 C.
C. 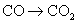 D.
D.
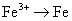
2. 吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,科学家尝试用Na2SeO3消除人体内活性氧,则Na2SeO3的作用是( )
A.氧化剂 B. 还原剂
C.既是氧化剂又是还原剂 D.以上均不是
1.下列变化中,必须加入氧化剂才能发生的是 ( )
A.SO2→S B.SO32- →SO2 C.HCO32- →CO32- D.I-→I2
2. 单线桥--表示电子转移情况

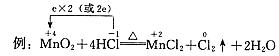
要点:(1)单箭号(在反应物之间);
(2)箭号起点为被氧化(失电子)元素,终点为被还原(得电子)元素;
(3)只标转移电子总数,不标得与失(氧化剂得电子总数等于还原剂失电子总数)。
例5.判断下列反应哪些是氧化还原反应,哪些是非氧化还原反应?是氧化还原反应的用单线桥(或双线桥)表示电子转移的方向和数目,并指出氧化剂和被氧化的物质。
(1)Cl2+2KI=2KCl+I2
(2)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
解析: (1)中氯元素化合价由0下降到-1,被还原,Cl2是氧化剂;碘元素化合价由-1升高到0,被氧化,KI是被氧化的物质。(3)氮元素化合价由+5下降到+2,被还原,硝酸是氧化剂;铜元素化合价由0升高到+2,被氧化,铜是被氧化的物质;(2)中无元素化合价变化,是非氧化还原反应
答案:(1)(3)是氧化还原反应,(2)是非氧化还原反应。
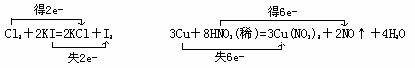
(1)中Cl2是氧化剂,KI是被氧化的物质;(3)中硝酸是氧化剂,铜是被氧化的物质。
[强化训练]
1. 双线桥--表示电子得失的结果
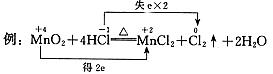
 要点:(1)双箭号(从反应物指向生成物);
要点:(1)双箭号(从反应物指向生成物);
(2)箭号起、止所指为同一种元素;
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)。
2. 化合反应、分解反应、置换反应与氧化还原反应的交叉分类示意图
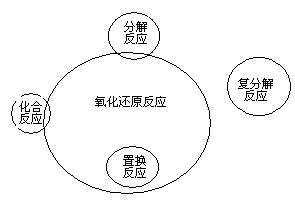
置换反应一定是氧化还原反应,化合反应、分解反应可能是氧化还原反应,复分解反应都不是氧化还原反应。
1、 把化学反应分成氧化还原反应、非氧化还原反应和四种基本类型反应,是两种不同的分类方法。前者分类根据化学反应实质,后者分类根据反应物、生成物种类的多少和类别,所以从分类的根据上看,前者较后者更深入本质。
把化学反应分成氧化还原反应、非氧化还原反应和四种基本类型反应,是两种不同的分类方法。前者分类根据化学反应实质,后者分类根据反应物、生成物种类的多少和类别,所以从分类的根据上看,前者较后者更深入本质。
化学反应的不同分类方法的关系是:
|
基本类型 |
氧化还原反应 |
非氧化还原反应 |
|
化合 |
2Cu+O2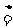 2CuO 2CuO |
CaO+H2O=Ca(OH)2 没有单质参加反应 |
|
分解 |
2KClO3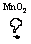 2KCl+3O2↑ 2KCl+3O2↑ |
NH4HCO3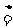 NH3↑+H2O+CO2↑ 没有单质生成 NH3↑+H2O+CO2↑ 没有单质生成 |
|
置换 |
Fe+2HCl=FeCl2+H2↑ |
|
|
复分解 |
|
H2SO4+Ba(OH)2=BaSO4↓+2H2O |
2、常见还原剂:在化学反应是易失电子被氧化的物质。
(1)典型的金属单质如:K、Ca、Na、Mg…(其还原性强弱与金属活动性基本一致)。
(2)某些非金属单质及氧化物如:H2、C、CO、SO2…。
(3)有变价元素的低价态化合物如:H2S、HI、HBr、HCI、FeSO4 、Na2SO3…。
(4)非金属阴离子如:S2-、I-、Br-、CI-…。
例3:某元素在化学反应中,由化合态变为游离态,则该元素( )
A. 一定被氧化 B. 一定被还原
C. 可能被氧化,也可能被还原 D. 化合价降低为0
解析:化合态时元素的化合价可能是正价,也可能是负价,转变成游离态0价,因此,元素可能是被还原也可能是被氧化,所以选C。
小结:金属元素只能失电子,只有正价,所以金属单质只有还原性;非金属元素既能得电子表现负价,又能失(偏离)电子表现正价,所以非金属单质多数既有氧化性又有还原性。
例4:从氧化、还原的观点分析氯气和盐酸的化学性质。
解析:氯气的化学性质,如氯气跟金属单质(钠、铁、铜……)、非金属单质(氢气、磷……)的反应中都是得电子,化合价降低被还原,作氧化剂,因此氯气具有强氧化性;但氯气也有还原性,如氯气跟水、碱溶液所发生反应,其中有一部分氯就是表现了还原性。
 盐酸也是既有氧化性又有还原性的。如在盐酸跟镁、铝、锌等较活泼金属发生的置换反应中,盐酸表现了氧化性。在浓盐酸跟二氧化锰反应制取氯气时,盐酸表现了还原性。由于盐酸的氧化性实质上是H+的氧化性,属于酸的通性,即绝大多数酸所具有的共同性质,因此不能把盐酸称为氧化性酸。
盐酸也是既有氧化性又有还原性的。如在盐酸跟镁、铝、锌等较活泼金属发生的置换反应中,盐酸表现了氧化性。在浓盐酸跟二氧化锰反应制取氯气时,盐酸表现了还原性。由于盐酸的氧化性实质上是H+的氧化性,属于酸的通性,即绝大多数酸所具有的共同性质,因此不能把盐酸称为氧化性酸。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com