
2、锂与氧气化学方程式:
钾与氧气化学方程式:
1、递变规律:从上到下原子半径 ,原子核对最外层电子的束缚力 ,失电子能力 ,元素的金属性 ,单质的还原性 ,与水或酸反应置换出氢的能力 ,最高价氧化物的水化物 性 .
 Na2O2
Na2O2



 Na
Na
 Na2O NaO H Na2CO3 NaHCO3
Na2O NaO H Na2CO3 NaHCO3
(方程式写在背面)
2、Na2CO3 与NaHCO3
Na2CO3 俗名: 色态: 溶解性: 热稳定性:
NaHCO3俗名: 色态: 溶解性: 热稳定性:
Na2CO3 和NaHCO3分别与酸反应 速率:V(Na2CO3) V(NaHCO3)
1、Na2O2:颜色状态 电子式: 用途:
与H2O 、CO2化学方程式
1、钠的化学性质 钠的原子结构示意图:
跟非金属反应:(O2、Cl2、S)对应的化学方程式:
、 、
(2)与H+反应(H2O、酸、盐溶液)
①钠与水反应,标出电子转移:
现象及解释:浮: 熔:
游:产生气体,在水面上向各方迅速游动最后消失 .嘶
红:
②钠与盐酸离子方程式:
③钠投入硫酸铜溶液中化学方程式:
(3)与有机物反应(醇、酚、羧酸)与乙醇化学方程式:
17.已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:
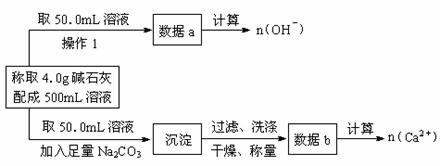
① 写出n (OH-)、n (Ca2+)与n (Na+)的关系:n(Na+)= n(H+)-2n(Ca2+) 。
② 设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH、CaO |
NaOH、CaO、 Ca (OH)2 |
NaOH、 Ca (OH)2 |
NaOH、 Ca (OH)2、H2O |
|
n
(Na+)、n
(Ca2+) 的关系 |
40x+56y
= 4 |
40x+56y<4.0<40x+74y |
40x+74y=4.0 |
4.0<40x-74y |
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。
他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g。请通过计算确定该碱石灰各成分的质量分数。
ω(H2O)=10.5%
ω[Ca(O H)2]=77.1%
ω(NaOH)=12.4%
15.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是___A、B、D____
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
17.已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:

① 写出n (OH-)、n (Ca2+)与n (Na+)的关系:n(Na+)= 。
② 设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH、CaO |
NaOH、CaO、 Ca (OH)2 |
NaOH、 Ca (OH)2 |
NaOH、 Ca (OH)2、H2O |
|
n
(Na+)、n
(Ca2+) 的关系 |
40x+56y
= 4 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。
他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g。请通过计算确定该碱石灰各成分的质量分数。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
B |
B |
D |
B |
A |
A |
D |
BC |
B |
A |
A |
C |
B |
A |
15.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com