
25.下列离子方程式书写正确的是 ( )
A.AgNO3溶液中滴入少量的Na2S溶液 2Ag++S2-=Ag2S↓
B.过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HclO
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液
2HSO3-+Ba2++2OH-=BaSO3↓+SO32-+2H2O
24.矿石中金的含量很低,其性质又相当稳定,只能用湿法冶金一氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸取入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为:
①4Au+8NaCN+O2+2H2O=4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn=2Au+Na2[Zn(CN)4]
以下有关氰化法提炼金的说汉中正确的是 ( )
A.用氰化法提炼金不会污染环境
B.化合物Na[Au(CN)2]中金元素的化合价为+1
C.金元素在地壳中能以游离态的形式存在
D.在提炼过程中含金元素的物质始终作氧化剂
23.在溶液中加入中量Na2O2后仍能大量共存的离子组是 ( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.K+、Na+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
22.关于物质的检验,下列判断正确的是 ( )
A.在溶液中加入AgNO3溶液,生成不溶于硝酸的沉淀,则原溶液中一定有Cl-存在
B.在溶液中加入Ba(NO3)2溶液,再加入足量盐酸酸化, 如果生成白色沉淀,则原溶液中一定有大量的SO42-存在
C.在溶液中加入浓NaOH溶液,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液中一定有NH4+存在
D.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在
20.下列各组离子在指定的环境中能大量存在的是 ( )
A.在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl-
B.在能使石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3-
D.由水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3-
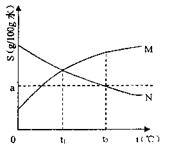 21.右图是M、N两种物质的溶解度曲线,在t2℃时往两个盛有100g水的烧杯中分别加入agM和agN(溶质仍是M、N),充分搅拌。将混合物的温度降低到t1℃,下列说法正确的是 ( )
21.右图是M、N两种物质的溶解度曲线,在t2℃时往两个盛有100g水的烧杯中分别加入agM和agN(溶质仍是M、N),充分搅拌。将混合物的温度降低到t1℃,下列说法正确的是 ( )
A.t2℃时,得到M的饱和溶液
B.t2℃时,得到N的不饱和溶液
C.温度降低到t1℃时,M、N的溶质质量
分数相等,得到M、N的不饱和溶液
D.温度降低到t1℃时,M、N的溶解度相
等,得到M、N的饱和溶液
19.下列物质能跟镁反应并生成氢气的是 ( )
A.甲酸溶液 B.氢氧化钠溶液 C.氯化铵溶液 D.碳酸钠溶液
18.相对分子质量为M的某物质在室温下的溶解度为Sg,此时测得该物质饱和溶液的密度为dg/cm3,则该饱和溶液的物质的量浓度为 ( )
A.M/10Sd B.1000Sd/M(100+S)
C.10Sd/M D.M(100+S)/1000Sd
17.A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):
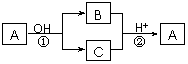
下列说法中不正确的是 ( )
A.X元素可能为Al B.X元素一定为非金属元素
C.A可能是Cl2 D.反应①和②一定为氧化还原反应
16.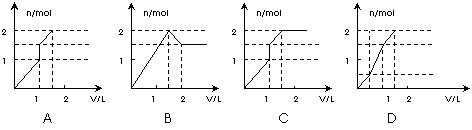 向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L 的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液的体积(V)之间的关系图正确的是 ( )
的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液的体积(V)之间的关系图正确的是 ( )
15.粗碘中通常含有ICl和IBr,称为卤素互化物,其性质和卤素相似,都是较强的氧化剂,而且受热时ICl和IBr都像I2一样能升华。在粗碘中加入下列选项中的一种物质后,再进行升华可得到精碘,则应加入的物质是 ( )
A.H2O B.KI C.Zn D.KCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com