
器材:充满气体的气球、底部刺孔的扁平塑料瓶、水、量筒、橡胶薄膜,小瓶
重点:
(1)了解压缩气体的获得过程。
(2)了解压缩气体在实际生活中的应用,并能运用所学的知识解释这些现象。
难点:综合应用气体的实验定律来解释生活实际中的压缩气体的应用问题。
3、情感、态度与价值观:
(1)通过了解压缩气体在生活中非常普遍的运用,感悟科学、技术与社会发展之间的关系。
(2)通过对生活实际中压缩气体的应用实例的分析和讨论,激发学习兴趣,体会从生活到物理,再从物理到生活的思想方法。
(3)通过实验和讨论,体会分工合作在实验中的作用,增加合作意识。
2、过程与方法:
(1)通过对“扁平塑料瓶实验”的分析和研究,明白一定质量的气体,如果温度不变,减小气体的体积就能获得压缩气体。
(2)通过气体实验定律的复习,明白一定质量气体,如果体积不变,升高气体的温度就能获得压缩气体。
(3)运用所学的气体实验定律,通过学生间的交流与讨论,分析并解释大客车车门的开关结构、宇航员的宇航服和沉浮子等生活实际现象中的物理原理。
1、知识与技能:
(1)知道压缩气体,知道压缩气体在实际生活中有着非常广泛的应用。
(2)知道获得压缩气体的两种方式:保持一定质量的气体温度不变,减小气体的体积;保持一定质量的气体体积不变,升高温度,以获得压缩气体。
“压缩气体的应用”这节是这一章《分子和气体定律》的最后一节的内容,是在学习了气体的两条实验定律--玻意耳定律和查理定律后,应用两条气体的实验定律解释实际生活中的具体问题。
学习本节的知识需理解气体的两条实验定律,即玻意耳定律和查理定律,理解气体的体积和温度发生变化时,气体的压强会随之发生变化。一定质量的气体,在温度一定时,减小气体的体积可以增加气体的压强;在体积一定时,升高温度可以增加气体的压强。
本节教学中,首先通过一些生活中具体的实例引入压缩气体的概念,然后,让学生动手实验--“扁平塑料瓶实验”,明白一定质量的气体,保持温度不变并减小其体积,就可以获得压缩气体。通过对气体实验定律的复习,知道一定质量的气体,当体积不变时,通过升高温度的方法也可以获得压缩气体。然后,再运用这一知识解释大客车车门开关结构和宇航员的宇航服问题,以及解释高压锅的问题。并指导学生动手制作沉浮子,体会和解释潜水艇的工作原理。
本节教学中,从对压缩气体的实际运用,感悟科学、技术和社会发展之间的关系,体会从生活到物理,再从物理到生活的物理思想方法。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式__________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。正极反应______,负极反应___________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+
的实验步骤: 。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式 、 劣质不锈钢腐蚀的实验现象: 。
解析:本题第三问涉及应用FeCl3水解的知识除杂的问题,欲一起除去CuCl2溶液中Fe3+和Fe2+,应该首先将Fe2+氧化为Fe3+,然后加入氧化铜调节溶液的pH,氧化铜与Fe3+水解生成的H+反应,促进Fe3+水解平衡正向移动生成Fe(OH)3沉淀而除去。
(二)促进FeCl3水解
3、如何配制Fe(OH)3胶体?
将12 mL饱和FeCl3溶液滴入20 mL沸水中,继续加热至红褐色为止。化学方程式:
4、如何除去MgCl2溶液中少量的FeCl3?
可以利用FeCl3的水解反应,向溶液中加入氧化镁、碳酸镁等,消耗FeCl3水解产生的HCl,促进FeCl3水解,生成MgCl2,这样既不引入新的杂质,又能将FeCl3转化为Fe(OH)3沉淀除去。
5、实验中手不慎被玻璃划破,FeCl3溶液为何能够应急止血?
血液是一种胶体,其中的血液胶体微粒带负电荷,遇到FeCl3溶液(溶液中含有带正电荷的Fe(OH)3胶粒)将其电荷中和掉,使血液胶体发生聚沉,从而起到止血的作用。
(一)抑制FeCl3水解
1、实验室如何配制FeCl3溶液?
为了抑制FeCl3水解,将FeCl3固体溶于较浓的盐酸中,然后用蒸馏水稀释至所需要的浓度。
2、加热FeCl3溶液能得到无水FeCl3固体吗?如何得到无水FeCl3固体?
FeCl3溶液中存在FeCl3的水解平衡,加热促进其水解,又由于生成的氯化氢气体不断挥发,使水解趋于完全,生成的Fe(OH)3在灼烧时发生分解反应2Fe(OH)3 Fe2O3十3H2O,最终得到的是Fe2O3,而得不到无水FeCl3固体。
要想得到无水FeCl3固体,需要抑制FeCl3水解,可以将FeCl3溶液在HCl气流中蒸干。
FeCl3属于强酸弱碱盐,溶于水后Fe3+发生水解,使溶液显酸性。
FeCl3+3H2O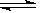 Fe(OH)3+3HCl,离子方程式为Fe3++3H2O
Fe(OH)3+3HCl,离子方程式为Fe3++3H2O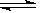 Fe(OH)3+3H+。实验测得,FeCl3的水解程度较大,在加热或稀释条件下,水解平衡正向移动,如果加入电解质会影响到溶液中H+浓度,也会影响FeCl3的水解程度。FeCl3溶液的水解以及水解平衡的移动在实际中有很多应用,是高考的热点之一。
Fe(OH)3+3H+。实验测得,FeCl3的水解程度较大,在加热或稀释条件下,水解平衡正向移动,如果加入电解质会影响到溶液中H+浓度,也会影响FeCl3的水解程度。FeCl3溶液的水解以及水解平衡的移动在实际中有很多应用,是高考的热点之一。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com