
12.把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时X与盐酸反应时,其中反应速率最大的是 ( )
A.20mL 3mol/L的X溶液 B.20mL 2mol/L的X溶液
C.10mL 4mol/L的X溶液 D.10mL 2mol/L的X溶液
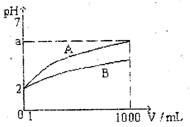 13.PH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如右图所示,则下列说法不正确的是 ( )
13.PH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如右图所示,则下列说法不正确的是 ( )
A.稀释后A酸溶液的酸性比B酸溶液弱
B.a=5时,A是强酸,B是弱酸
C.若A、B都是弱酸,则5>a>2
D.A、B两种酸溶液物质的量浓度一定相等
11.一定温度下,向a L体积固定的密闭容器中加入2molN2(g)、1molH2(g),发生如下反应:
 N2(g)
+3H2(g)
2NH3(g),此反应达到平衡状态的标志是 ( )
N2(g)
+3H2(g)
2NH3(g),此反应达到平衡状态的标志是 ( )
A.H2的体积分数不再发生变化
B.容器内气体原子总数不再发生变化
C.相同时间内消耗n mol N2的同时消耗3n mol H2
D.容器内气体的密度不在发生变化
10.某学业生的实验报告中有下列数据:①用托盘天平称取11.7g氯化钠;②用100mL的量筒量取21.48mL盐酸;③用容量瓶配制216mL 1mol/L的氯化钠溶液;④用酸式滴定管量取25.00mL硫酸溶液;⑤用pH试纸测定H2SO4溶液的pH为3.23。其中合理的是( )
A.只有①④ B.只有②④ C.只有①③ D.只有②⑤
9.下列离子方程式中,属于盐类水解反应的是 ( )

 A.H2PO4-+H2O H33O++PO43- B.CH3COO-+H3O CH3COOH+H2O
A.H2PO4-+H2O H33O++PO43- B.CH3COO-+H3O CH3COOH+H2O

 C.Cl2+H2O H++Cl-+HClO D.Al3++3HCO3- Al(OH)3↓+3CO2↑
C.Cl2+H2O H++Cl-+HClO D.Al3++3HCO3- Al(OH)3↓+3CO2↑
8. 在一恒温恒压密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g) C(g)+3D(g)现分别从两条途径建立平衡:I、A、B的起始量均为2mol;II、C、D的起始量分别为2mol和6mol。下列叙述正确的是 ( )
在一恒温恒压密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g) C(g)+3D(g)现分别从两条途径建立平衡:I、A、B的起始量均为2mol;II、C、D的起始量分别为2mol和6mol。下列叙述正确的是 ( )
A.达到平衡时,途径I的气体密度为途径II密度的1/2
B.I、II两途径最终达到平衡时,体系内各气体的浓度不同
C.达到平衡时,途径I和途径II体系内混合气体平均相对分子质量不同
D.I、II两途径最终达到平衡时,体系内混合气体的百分组成相同
7. 在一定条件下,当单独改变可逆反应:N2(g)+3H2(g) 2NH3(g);△H<0的某一条件后,下列叙述中错误的是 ( )
在一定条件下,当单独改变可逆反应:N2(g)+3H2(g) 2NH3(g);△H<0的某一条件后,下列叙述中错误的是 ( )
A.加入催化剂,V正、V逆都发生变化,且变化的倍数相等
B.增大压强,V正、V逆都增大,V正增大的倍数大于V逆增大的倍数
C.降低温度,V正、V逆都减小,且V正减小的倍数小于V逆减小的倍数
D.加入氩气,V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数
6. 一定温度下,在固定容积的密产容器中发生下列反应:2HI(g) H2(g)+I2(g)。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.7mol·L-1降到0.05mol·L-1时,所需反应的时间为 ( )
一定温度下,在固定容积的密产容器中发生下列反应:2HI(g) H2(g)+I2(g)。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.7mol·L-1降到0.05mol·L-1时,所需反应的时间为 ( )
A.等于5s B.等于10s C.大于10s D.小于10s
5.某溶液中由水电离出来的c(OH-)=10-12mol/L,则该溶液中的溶质不可能是 ( )
A.HCl B.NaOH C.NH4Cl D.H2SO4
4.下列事实不能用勒夏特列原理解释的是 ( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转率
 B.对于2HI(g) H2(g)+I2(g);△H>0,缩小容器的体积可使颜色变深
B.对于2HI(g) H2(g)+I2(g);△H>0,缩小容器的体积可使颜色变深
C.在实验室可用排饱和食盐水的方法收集氯气
D.打开冰镇啤酒,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫
3.下列有关pH变化的判断中,正确的是 ( )
A.随着温度升高,碳酸钠溶液的pH减小
B.随着温度升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com