
2. 与金属的导电原理(通过内部自由电子的定向移动)不同,电解质溶液之所以能够导电,是因为溶液中存在自由移动的离子;在一定浓度范围内,溶液导电能力的强弱与溶液中离子的浓度有关:离子浓度越高,溶液的导电能力越强。
与金属的导电原理(通过内部自由电子的定向移动)不同,电解质溶液之所以能够导电,是因为溶液中存在自由移动的离子;在一定浓度范围内,溶液导电能力的强弱与溶液中离子的浓度有关:离子浓度越高,溶液的导电能力越强。
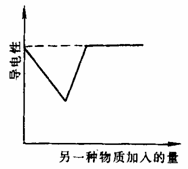
例2.如图是向不同电解质溶液中加入另一种物质后溶液导电性变化曲线,以下四个实验中,属于图中曲线的是( )。
A. 氢氧化钡溶液中滴加同浓度的硫酸至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水通入二氧化碳至过量
D. 氢硫酸中通入二氧化硫至过量
答案:AC
1.电解质溶于水或受热熔化时离解成自由移动离子的过程称为电离。
强电解质在水中完全电离,属不可逆过程,溶液中不存在强电解质的电离平衡:
HCl = H+ + Cl- Ba(OH)2 = Ba2+ + 2OH- (NH4)2SO4 = 2NH4+ + SO42-
弱电解质在水中部分电离,属可逆过程,溶液中存在弱电解质的电离平衡;弱电解质在水溶液中的电离趋势很小,并且,多元弱电解质的电离是分步进行的,书写弱电解质的电离方程式常用符号" ":
":
NH3·H2O NH4+ + OH-
NH4+ + OH-
H2CO3 H+ + HCO3- HCO3-
H+ + HCO3- HCO3- H+ + CO32-
H+ + CO32-
电解质溶液是电中性的,即阳离子所带的正电荷和阴离子所带的负电荷电量相等。
|
|
强
电 解 质 |
弱
电 解 质 |
|
概念 |
在水溶液中全部电离成离子的电解质 |
在水溶液中只有一部分电离成离子的电解质 |
|
电离程度 |
完全 |
部分 |
|
溶液里粒子 |
水合离子 |
水合分子、水合离子 |
|
物质结构 |
离子化合物、某些共价化合物 |
某些共价化合物 |
|
与常见物质类别的关系 |
通常为 强酸:HCl、H2SO4、HNO3等 强碱:NaOH、KOH、Ba(OH)2等 绝大多数盐:NaCl、CaCO3、CH3COONa等 |
通常为 弱酸:CH3COOH、HF、HClO、H2S、H2CO3、H2SiO3、H4SiO4等 弱碱:NH3·H2O、Cu(OH)2等 极少数盐、水 |
根据化合物在水溶液或熔化状态下能否导电,可将其划分为电解质、非电解质。电解质有强、弱之分,强电解质、弱电解质的本质区别在于它们在溶液中的电离程度不同。电解质在水中的溶解程度和电离程度可能不一致,在水中溶解程度大的不一定是强电解质(如醋酸),在水中溶解程度小的不一定是弱电解质(如硫酸钡)。
|
|
电 解 质 |
非
电 解 质 |
|
定
义 |
在水溶液中或熔化状态下能导电的化合物 |
在水溶液中和熔化状态下都不导电的化合物 |
|
相同点 |
都是与溶解性无关的化合物 |
|
|
不同点 |
在一定条件下能电离 |
不能电离 |
|
在水溶液中或熔化状态下能导电 |
在水溶液中和熔化状态下都不导电 |
|
|
与常见物质类别的关系 |
离子化合物和部分共价化合物 |
全是共价化合物 |
|
通常为酸、碱、盐、水、典型金属氧化物、某些非金属氢化物等 |
通常为非金属氧化物、某些非金属氢化物、绝大多数有机物等 |
例1.下列物质属于电解质的是( )
A.SO2 B.Cu C.氨水 D.NaCl E.NaOH F.HCl G.酒精 H.AgCl
解析:电解质应该是化合物,铜(单质)、氨水(混合物)不是电解质;电解质的导电条件是在水溶液里或熔化状态下,氯化银虽然其水溶液几乎不导电,但在熔化状态下导电,因此它是电解质;电解质导电必须是用化合物本身电离出自由移动的离子而导电,不能是发生化学反应生成的物质导电,如二氧化硫水溶液导电,是由于二氧化硫与水反应生成的亚硫酸能导电,所以二氧化硫不是电解质;蔗糖、酒精等化合物,无论是固态或其水溶液都不导电,这些化合物是非电解质。
答案:D、E、F、H。
4.某烃A与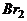 发生加成反应,产生二溴衍生物B;B用热的NaOH-乙醇溶液处理得到化合物C;经测试知C的结构中含有两个双键,化学式是
发生加成反应,产生二溴衍生物B;B用热的NaOH-乙醇溶液处理得到化合物C;经测试知C的结构中含有两个双键,化学式是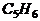 ;将C催化加氢生成环戊烷。写出A、B、C的结构式。
;将C催化加氢生成环戊烷。写出A、B、C的结构式。
3.1mol 与溴水完全反应,需要溴单质的物质的量为
A.3 mol B.4mol C.5 mol D.6mol
2.由2-溴丙烷为原料制取1、2-丙二醇 ( )时需经过的反应依次是 ( )
A.加成-消去-取代 B.取代-消去-加成
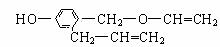 C.取代-加成-消去
D.消去-加成-取代
C.取代-加成-消去
D.消去-加成-取代
1.要检验某卤乙烷中的卤素是否是溴元素,正确的实验方法
A.加入氯水振荡,观察水层是否有棕红色溴出现
B.滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,冷却后加入稀HNO3至酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成。
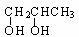 D.加入NaOH醇溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成
D.加入NaOH醇溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成
2.基团的保护
(1)基团保护 ①醛基的保护 如:

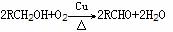
②双键的保护 如:
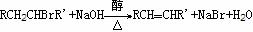
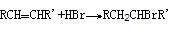
③羟基的保护 如:
R-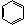 -OH
-OH R-
R-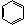 -OCH3
-OCH3
R-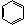 -OCH3
-OCH3 R-
R-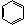 -OH
-OH
④羧基的保护 如:
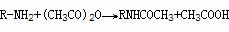


⑤氨基的保护如:

[巩固练习]
1.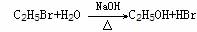 基团的引入 (1)羟基的引入
基团的引入 (1)羟基的引入
①取代法 例:

②水化法 例: CH2=CH2 +H2O CH3CH2OH

③还原法 例:CH3CHO +H2 CH3CH2OH
 ④氧化法 例:2CH3CH2CH2CH3+5O2
4CH3COOH+2H2O
④氧化法 例:2CH3CH2CH2CH3+5O2
4CH3COOH+2H2O

⑤水解法 例:CH3COOCH2CH3+H2O CH3CH2OH+CH3COOH
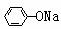
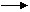 ⑥酸化法 例:
+ HCl
+H2O
⑥酸化法 例:
+ HCl
+H2O
(2)羟基的消去
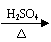
 ①脱水法 例: CH3CH2OH
CH2=CH2 +H2O
①脱水法 例: CH3CH2OH
CH2=CH2 +H2O

②氧化法 例: 2CH3CH2OH+O2 2CH3CHO +2H2O
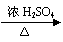 ③酯化法 例:
③酯化法 例:
CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
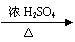
④取代法 例:CH3CH2OH +HBr CH3CH2Br+H2O
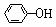
 ⑤中和法 例:H3C-
⑤中和法 例:H3C-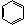 -OH +
NaOH H3C-
-OH +
NaOH H3C-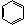 -O Na +H2O
-O Na +H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com