
27.下列叙述中正确的是
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱和溶液,又有CaCO3沉淀生成。
B.向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
C.等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2 CO3饱和溶液中通入CO2,有固体结晶析出
26.用标准盐酸溶液滴定未知浓度的氢氧化钠溶液,如果测得结果偏低,则产生误差的原因可能是则产生误差的原因可能是下列叙述中的( )
A.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定
B.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失
C.酸式滴定管未用标准盐酸溶液润洗
D.把氢氧化钠待测液移入锥形瓶中时,有少量碱液溅出
25.不溶于水的氧化亚铜可溶于含硫酸铁的硫酸溶液中,这时生成的硫酸亚铁可用酸性高锰酸钾溶液滴定,从而测定氧化亚铜的量:Cu2O+Fe2(SO4)3+H2SO4--FeSO4+CuSO4+H2O FeSO4+KMnO4+H2SO4--Fe2(SO4)3+MnSO4+K2SO4+H2O 由上述反应知;0.1mol/L的KMnO4溶液1mL相当于氧化亚铜的量是
A. 360mg B. 3.6g C. 0.36g D. 2.5×10-4mol
24.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是( )
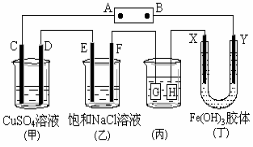
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液选是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带正电荷
23.根据下表信息,下列叙述中正确的是( )
|
序号 |
氧化剂 |
还原剂 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
FeCl3 |
|
② |
KMnO4 |
H2O2 |
O2 |
MnO2 |
|
③ |
KClO3 |
浓盐酸 |
Cl2 |
|
|
④ |
KMnO4 |
浓盐酸 |
Cl2 |
MnCl2 |
A.表中①反应的氧化产物只能有FeCl3
B.表中②生成1mol的O2将有4mol的电子转移
C.表中④的离子方程式配平后,H+的化学计量数为16
D.表中③还原产物是KCl
22.下列离子方程式书写正确的是( )
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:
Ca2++2HCO3-+2OH-=CaCO3¯+2H2O+CO32-
B.向NaAlO2溶液中加盐酸至溶液呈酸性:A1O2-+4H+=Al3++2H2O
C.向碳酸氢铵溶液中加入过量的NaOH溶液:HCO3-+OH-=CO32-+H2O
D.Cl2与H2O反应:Cl2+H2O=2H++Cl-+C1O-
21.NA代表阿伏加德罗常数,下列叙述正确的是( )
A.10g质量分数为98%的H2SO4中含有H2SO4的分子数为0.01 NA
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移NA个电子
C.200mL lmol/LFe2(SO4)3溶液中,Fe3+和SO42-离子的总数是NA
D.14g乙烯和丙烯的混合物中总原子数为3NA.
20.随着科学技术的不断进步,研究物质的手段和途径越来越多,许多分子及分子碎片如C60、N5+、H3、O4等已相继被发现。下列有关这些物质的说法中,正确的是( )
A.N5+离子中含有36个电子 B.C60的摩尔质量为720g
C.H2和H3属于同素异形体 D.O2和O4属于同位素
19.在常温下10 mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(忽略溶液体积变化),则对反应后溶液的叙述正确的是( )
A.c(A-)<c(K+) B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V后≥20 mL D.V后≤20 mL
18. 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2-+Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com