
37.(8分)
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如下图所示:

已知R-CH=CHOH(烯醇)不稳定,很快转化为 。
。
根据以上信息回答下列问题:
(1)A的分子式为 ;
(2)反应②的化学方程式是 ;
(3)A的结构简式是 ;
(4)反应①的化学方程式是
;
(5)A有多种同分异构体,其中与A具有相同官能团的同分异构体(不包括A)共有______种
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为
河北衡水中学2009-2010学年度小学期调研考试
36.(10分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶处 。
。
II将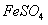 溶液与稍过量的
溶液与稍过量的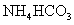 溶液混合,得到含
溶液混合,得到含 的浊液
的浊液
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到 固体
固体
V煅烧 ,得到
,得到 固体
固体
已知: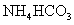 在热水中分解
在热水中分解
(1) I中,加足量的铁屑出去废液中的 ,该反应的离子方程式是
,该反应的离子方程式是
(2)
III中,生成 的离子方程式是
。若
的离子方程式是
。若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
(3) IV中,通过检验 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 操作是是
操作是是
(4) 已知煅烧 的化学方程式是
的化学方程式是 ,现煅烧464.0kg的
,现煅烧464.0kg的 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有 ,则该产品中
,则该产品中 的质量是
kg(摩尔质量/g·
的质量是
kg(摩尔质量/g·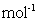 :
: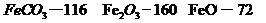 )
)
35.(8分)下图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极。
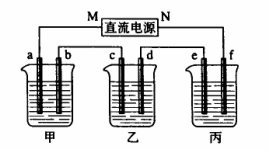
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
⑴电源的N端为__________________极
⑵电极b 上发生的电极反应为_______________________________________________
⑶列式计算电极b上生成的气体在标状况下的体积______________________________
⑷电极c的质量变化是________________g
34. (7分)以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)将燃烧黄铁矿的化学方程式补充完整
4 +11
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高 的转化率
的转化率
c. 使用催化剂能提高 的反应速率和转化率
的反应速率和转化率
d. 沸腾炉排出的矿渣可供炼铁
(4)每160g 气体与
气体与 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的 和铵盐。
和铵盐。
① 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的 。
。 吸收
吸收 的离子方程式是
。
的离子方程式是
。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
33.(10分)短周期元素A、B、C、D原子序数依次增大,其中只有一种为金属元素。A、C同主族,B的最外层电子数为次外层的3倍。B、C的最外层电子数之和与D的最外层电子数相等。
(1)写出D的最高价氧化物对应水化物的化学式
(2)C2B2的电子式为 ,其中含有的化学键类型为
(3)由上述四种元素中的任意三种可以组成两种常见化合物,水溶液均显碱性,D的
单质可以与其中一种化合物反应生成另外一种化合物。写出该反应的离子方程式
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为
32.(5分)某同学用NaOH固体配制250mL 2mol/L的NaOH溶液,并进行有关实验。请回答下列问题:
(1)需要称取NaOH固体__________g。
(2)配制该NaOH溶液时使用的仪器除托盘天平(砝码、镊子)、药匙、量筒、250mL容量瓶、胶头滴管外,还必须用到的仪器有 、 等。
(3)取所配制的NaOH溶液100mL,与一定质量的铝充分反应,铝全部溶解后,生成的气体在标准状况下的体积为3.36L,则参加反应的铝的质量为 g,设反应后溶液的体积仍为100mL,则反应后溶液中OH-的物质的量浓度为(不考虑水解) 。
31.(7分) 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_________,A中反应 的离子方程式是____________________________________。
的离子方程式是____________________________________。
(2)实验开始时应先将活塞E_________(填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是___________________________。
(3) 关闭活塞E及分液漏斗上的活塞加入适量硫酸,硫酸与铁屑接触后产生气体。待收集到足量气体后关闭活塞E,现象是____________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________________。
30、由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如在右图转化关系(部分生成物和反应条件略去)

下列推断不正确的是
A.若X是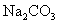 ,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是 ,则E一定能还原
,则E一定能还原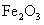
C.若D为CO,C能和E反应,则A一定为 ,其电子式是
,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
Ⅱ卷(共50分)
29.取一张用饱和NaCl溶液浸湿的蓝色石蕊试纸,两根铅笔芯作
电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现
一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法正确的是
A.b电极与电源的正极相连接
B.电解过程中,水既是氧化剂又是还原剂
C.a极附近溶液的pH变小
D.b极的电极反应式是4OH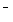 -4e
-4e ===O2+2H2O
===O2+2H2O
28、三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”,饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性。有关说法符合题意的
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO 使人体中的蛋白质变性
使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为Cu2++ 2OH-=Cu(OH)2
 A.①④ B.②④
C.③ D.均不正确
A.①④ B.②④
C.③ D.均不正确
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com