
20、(10分)某兴趣小组为探究Na2O2滴入酚酞试液中时溶液颜色变化的原因,设计如下方案。将2角匙Na2O2加入滴有3~4滴酚酞试剂的蒸馏水(10ml)中,发现有如下现象:
①立即有大量气泡生成。
②无色透明的酚酞溶液迅速变红,振荡后,溶液中的红色褪去,重新变为无色。
③反应放出大量的热量,试管壁手触感觉很烫。
请回答:
(1)写出Na2O2与水反应的离子方程式: ,
如何检验生成的气体是氧气? 。
(2)该兴趣小组同学认为酚酞试液颜色变化的原因可能是:
① 。
②Na2O2与水反应生成的NaOH溶液浓度太大,使得酚酞变性,不显颜色。
③可能是反应放出的热量,使红色消失。
(3)假如是原因②请帮助该兴趣小组同学设计补充试验进一步说明酚酞试液褪色的原因 。
。
(4)为验证原因③,可以设计补充实验验证。请写出操作过程
。
19、(12分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-,现每次取100.00mL进行实验。
①第一份加入AgNO3溶液有沉淀产生。②第二份加足量NaOH后加热,收集到气体0.896L(标准状态下)。③第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩2.33g。试回答有关问题:
(1)判断K+、Cl-是否存在?K+ ;Cl- (填下列序号)。
A.一定存在 B.可能存在 C.一定不存在
(2)肯定存在的离子及在原溶液中的物质的量浓度分别为:
。
18、(14分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
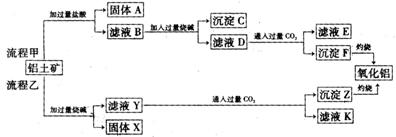
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)滤液D中通入过量的CO2的离子方程式为 。
(4)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称或化学式)。
(5)滤液E、K中溶质的主要成分是 (填化学式),用离子方程式表示
该溶液的酸碱性 。
(6)已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)= 。
17、(9分)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO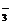 、SO
、SO 、Cl-、I-、HCO
、Cl-、I-、HCO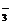 ,取该溶液实验如下:
,取该溶液实验如下:
|
实验步骤 |
实验现象 |
|
①取少量该溶液,加几滴甲基橙 |
溶液变红色 |
|
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,后在空气中又变成红棕色 |
|
③取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
|
⑤取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)溶液中可能存在的离子是________________________。
16、(14分)中学化学中几种常见物质的转化关系如下:其中A为日常生活中常见的金属单质(提示:A与硫反应生成低价态)

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B的化学式:A ,B 。
(3)①写出由D溶液生成红褐色胶体的离子方程式:
②B与稀硫酸反应的离子方程式:
③写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
。
15、(10分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
14、铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A、9.02g B、8.51g C、8.26g D、7.04g
13、含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a, 2Fe2-+Cl2=2Fe3++2Cl-
B.x=0.6a, 2Br-+ Cl2=Br2+2Cl-
C.x=a, 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a, 2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
12、某铁的“氧化物”样品,用2.5mol/L硫酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式为
A、Fe2O3 B、Fe3O4 C、Fe4O5 D、Fe5O7
11、在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1:9 B.1:1 C.1:2 D.1:4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com