
2.pH与溶液酸碱性的关系(25℃时)
表5-1 pH与溶液的酸碱性
|
pH |
溶液的酸碱性 |
|
pH<7 |
溶液呈酸性,pH越小,溶液的酸性越强 |
|
pH=7 |
溶液呈中性 |
|
pH>7 |
溶液呈碱性,pH越大,溶液的碱性越强 |
1.定义
pH= -lg c(H+),广泛pH的范围为0-14。
注意:当溶液中c(H+)或c(OH-)大于1mol时,不用pH表示溶液的酸碱性。
2.性质
(1)在稀溶液中,KW只受温度影响,而与溶液的酸碱性和浓度大小无关。
(2)在其它条件一定的情况下,温度升高,KW增大,反之则减小。
1.定义
H2O H++OH--Q,KW=c(H+)·c(OH-)
H++OH--Q,KW=c(H+)·c(OH-)
11.pH=12 C(OH-)=0.01mol/L C[Ba(OH)2]=0.005mol/L 设Ba(OH)2的体积为1L,则 n[Ba(OH)2]=0.005mol 根据Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O 反应后n(NaOH)=0.005mol 设NaHSO4的体积为xL,则 0.005mol/(1+x)L=0.001mol/L (根据pH=11) 解得:x=4 所以答案选:D
21、(6分)
(1) 1 + 6 + 14 = 2 + 6 + 7
(2)90,7%
解析:由反应②可知,反应①剩余的n(Cr2O72-)=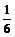 n(Fe2+)=0.0016
mol
n(Fe2+)=0.0016
mol
反应①消耗的n(Cr2O72-)=0.0050 mol-0.0016 mol=0.0034 mol
则n(CH3OH)=0.0034 mol
w(CH3OH)=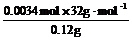 ×100%=90.7%
×100%=90.7%
注:下列题目解析:
10.采用定量法分析。假设有1molA12(SO4)3则溶液中含有2molA13+、3molSO42–。向溶液中逐滴加入Ba(OH)2溶液时发生的反应为:Al3++3OH-=Al(OH)3↓、
SO42–+Ba2+=BaSO4↓。则当2molA13+完全沉淀时,消耗Ba(OH)23mol,此时3molSO42–全部沉淀;生成沉淀为2molAl(OH)3和3molBaSO4共5mol,因此,在整个反应过程中BaSO4的物质的量始终大于Al(OH)3的物质的量;再加入Ba(OH)2溶液时发生Al(OH)3+OH-=[Al(OH)4]-,沉淀的量将逐渐减少,因此b点是沉淀的最大值,b-d中Al(OH)3沉淀逐渐溶解转化为Ba(AlO2)2,由于AlO2-微弱水解,因此再b-d中AlO2-的物质的量大于Ba2+;d点时Al(OH)3沉淀恰好完全溶解,此时溶液中只存在Ba(AlO2)2,因此随Ba(OH)2的加入在某一点,当d-e中加入的Ba(OH)2的物质的量等于Ba(AlO2)2的物质的量时,溶液中Ba2+与OH-的量相等。[答案]BD
20.(10分)
(1) 2Na2O2+2H2O=4Na++4OH-+O2↑ , 用带火星的木条检验,看能否使其复燃 。
(2)
① 有强氧化性物质生成,使酚酞氧化而褪色 。
(3) 取该溶液加水稀释,若变红,则证明(2)成立 。
(4) 取滴加酚酞的稀NaOH溶液加热,若红色消失,则证明(3)成立 。
19.(12分)
(1) A ; B 。
(2) c(NH4+)=0.4mol·L-1 , c(SO42-)=0.1 mol·L-1 , c(CO32-)=0.2 mol·L-1 , c(K+)≥0.2 mol·L-1 。
18.(14分)
(1) Al2O3+6H+=2Al3++3H 2O 。 (2) SiO2+2OH-=SiO32-+H2O 。
(3) AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 。 (4) KSCN 。
(5) NaHCO3 , HCO3-+H2O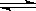 H2CO3+OH- 。
H2CO3+OH- 。
(6) 5.6×10-10mol·L-1 。
17.(6分)
(1) NO3-、SO42-、Mg2+、Al3+ 。 (2) Fe2+、HCO3-、I-、Ba2+ 。
(3) Na+、Cl- 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com