
3.性质: 在不触动封建土地私有制的前提下,对生产关系进行局部调整;是地主阶级挽救统治危机的改革
2.目的: 挽救危机,富国强兵,巩固和加强封建统治
1.时间:1069 皇帝:宋神宗 改革者:王安石 中心主张:富国(理财)
24.将磷酸溶液逐渐滴加到60mL的氢氧化钡溶液中,其溶液的pH与所加磷酸的体积之间的关系如下图所示(溶液的总体积看作原溶液体积与滴加入的溶液体积之和)。
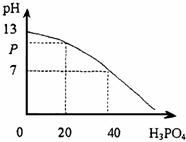
求:(1)pH为P时,生成沉淀的质量;
(2)pH为P时,溶液中c(OH-)。
23.NaOH和Ba(OH)2混合溶液的pH=14,取该溶液100mL,持续通CO2,当CO2通入体积为0.56L时生成沉淀最多。试通过计算(气体体积均指标态,设溶液体积不发生改变)回答:(1)NaOH和Ba(OH)2的物质的量浓度各是多少?(2)当通入CO2总体积为2.24升时,溶液中各离子(除H+、OH-)物质的量浓度各是多少?
21.取体积相同(0.025L)的两份0.10mol/L NaOH溶液,把其中一份放在空气中一段时间后,溶液的pH_______(填增大、减小或不变),其原因是________________。
*22.将0.05mol/L的盐酸溶液和未知浓度的氢氧化钠溶液以1∶2的体积比混合,所得混合溶液的pH为12。用上述氢氧化钠溶液滴定pH为3的某一元弱酸溶液20mL,达到终点时消耗氢氧化钠溶液12.5mL。试求:(1)氢氧化钠溶液的物质的量浓度。(2)此一元弱酸的物质的量浓度。(3)一元弱酸的电离度。
20.甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH-)之比_______(填大于、等于或小于)10。请说明理由。
19.配制99℃时的溶液100mL(KW=1×10-12)使其中c(OH-)为10-9mol/L,除纯水外,需要用pH=1的盐酸溶液________mL。
*15.若纯水中水的电离度为 1,pH=x的盐酸中水的电离度为
1,pH=x的盐酸中水的电离度为 2,pH=y的氨水中水的电离度为
2,pH=y的氨水中水的电离度为 3,两溶液等体积混合后溶液中水的电离度为
3,两溶液等体积混合后溶液中水的电离度为 4,若x+y=14(其中x≤6,y≥8),则
4,若x+y=14(其中x≤6,y≥8),则 1、
1、 2、
2、 3、
3、 4从小到大的顺序是:____________________。
4从小到大的顺序是:____________________。
*16.在25℃时,0.1mol/L
NaR的溶液中水的电离度为 1,在0.1mol/L盐酸中水的电离度为
1,在0.1mol/L盐酸中水的电离度为 2,若
2,若 1∶
1∶ 2=109,则0.1mol/L NaR溶液的pH为_______。
2=109,则0.1mol/L NaR溶液的pH为_______。
17.已知浓度均为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH⑥CH3COONa ⑦KCl ⑧NH4Cl其溶液pH由小到大的顺序是______________________。
*18.已知25℃时几种物质的电离度(溶液浓度为0.1mol/L)如下表:(已知H2SO4第一步电离是完全的)
|
①H2SO4溶液的H2SO4- |
②NaHSO4溶液中的HSO4- |
③CH3COOH |
④HCl |
|
10% |
29% |
1.33% |
100% |
(1)25℃时,0.1mol/L上述几种溶液中c(H+)由大到小的顺序是(填序号,下同)_______________。
(2)25℃时,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是______________。
(3)25℃时,将足量的锌粉投入等体积,pH等于1的上述几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是________________。
(4)25℃时,0.1mol/l H2SO4溶液中HSO4-的电离度小于0.1mol/L NaHSO4溶液中HSO4-的电离度的原因是_______________________。
14.在平衡体系:H2S H++HS-,HS-
H++HS-,HS- H++S2-中,当减小溶液pH时,则硫离子浓度会( )
H++S2-中,当减小溶液pH时,则硫离子浓度会( )
A.可能增大,也可能减小 B.增大
C.减小 D.无变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com