
2.集合A= ,B=
,B=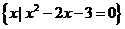 ,则
,则 =( )
=( )
A.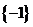 B.
B. C.
C.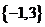 D.φ
D.φ
1.已知全集U=R,则正确表示集合 和
和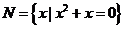 的关系韦恩(Venn)图是( )
的关系韦恩(Venn)图是( )
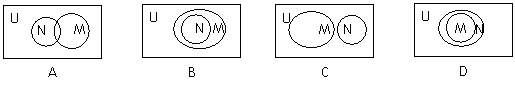
21.为了测定某铜银合金的成分。将30.0g合金完全溶于80ml 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到NO和NO2的混合气体共6.72L(标准状况),并测得溶液中氢离子浓度为1mol/L。假设反应后溶液的体积仍为80ml。试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
20.(共11分)抗击“非典”期间,过氧乙酸(CH3COOOH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
②H2O2+2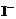 +2H+ = I2+2H2O
+2H+ = I2+2H2O
③CH3COOOH+2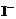 +2H+ = CH3COOH+I2+H2O
+2H+ = CH3COOH+I2+H2O
④I2 + 2S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填入以下方框内):
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(2)用单线桥法在下面已配平的化学方程式上标出电子转移的方向和数目:
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(3)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(4)取b0 L待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol· 。
。
(5)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 ________(填是或否)
19.按下列要求填空(共12分)
①向碳酸氢钙溶液中加入少量氢氧化钠溶液的离子方程式:________________________。
氯化铝溶液与NaHCO3溶液混合的离子方程式:_____________________________________。
②在KClO3 + 6HCl = KCl + 3Cl2 ↑ + 3H2O的反应中,被氧化的氯原子与被还原的氯原子的物质的量之比是_______________。
③强酸性的未知无色溶液中可能含有大量的Cl-、S2-、NO3-、CO32-、NH4+、Cu2+、Fe3+、Ag+等,现已检出有Ag+,你认为其中 __ __离子还需要鉴定是否存在,请写出检验该离子的离子方程式_____________________。
④某化合物的相对分子质量为m,在t℃时AmL该化合物的饱和溶液为Bg,将其蒸干后得到固体Cg。该化合物在t℃时的溶解度为 __g,该饱和溶液中溶质的物质的量浓度为 mol/L。
18. (13分)铝土矿的主要成分是A12O3,含有Fe2O3、
(13分)铝土矿的主要成分是A12O3,含有Fe2O3、
SiO2等杂质,按下列操作从铝土矿中提取A12O3。
回答下列问题:
(1)沉淀物的化学式分别是:
 ;d
;
;d
;
f ;
(2)写出加入过量NaOH溶液时所发生主要
反应的离子方程式 、
(3)写出通入气体B(过量)时溶液C中发生反应
的离子方程式 、 。
(4)气体B能否改用试剂A代替?为什么? , 。
17.(10分)实验室用烧碱配制500 mL 0.32mol·L-1的NaOH溶液。
①需称量 g的烧碱固体,固体应放在 中置于天平左盘称量。
②配制过程中,不需要使用的仪器是(填符号) 。
A.烧杯 B.量筒 C.玻璃棒 D.l000mL容量瓶 E.漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是 (填仪器名称)。
④由于操作上的不规范,下列使所配溶液的物质的量浓度偏低的是 : 偏高的是 :
A.称量时药品和砝码位置颠倒 B.称量时间过长
C.溶液未冷却即转入容量瓶 D.容量瓶洗净后未烘干
E.定容时俯视刻度线
F.定容后倒转摇匀,发现液面低于刻度线而未加水补充
16、含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
第Ⅱ卷 (非选择题,共52分)
15.在反应8NH3 + 3Cl2 = 6NH4Cl + N2中,被氧化的氨与未被氧化的氨的物质的量之比为:( )
A.8∶3 B.6∶1 C.3∶1 D.1∶3
14.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+= Fe3++Ce3+ Sn2++2Fe3+ = 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是: ( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+ 、Sn2+ D.Fe3+、Sn2+、Ce3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com