
14. (2009天津卷7)(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为______。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
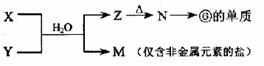
X溶液与Y溶液反应的离子方程式为_________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________。
[解析](5)本小题突破口在于Z加热分解得到N,N可以得到Al,说明N是Al2O3,Z是Al(OH)3.M是仅含非金属元素的的盐可推知为铵盐。结合①-⑧的各元素,可知X和Y水溶液反应,就是AlCl3和NH3的水溶液反应。最后一空,其实就是NH4Cl溶液中呈酸性,要使NH4+和Cl-浓度相等,根据电荷守恒,可得只要通氨气使溶液呈中性即可。
[答案](1)Na>Al>O (2)HNO3>H2CO3>H2SiO3 (3) 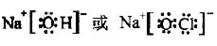 (4)a b
(4)a b
(5)Al3++3NH3·H2O=Al(OH)
3↓+3NH4+
2Al2O3(熔融) 4Al+3O2↑ 溶液的pH等于7
4Al+3O2↑ 溶液的pH等于7
[考点分析]本题主要考查物质结构和元素化合物的相关知识。前4小题,应该是目前物质结构知识中最简单的,因为只要识记就能得到①-⑧的各元素,从而从容应答。
13.(山东省临清一中2009届高考理综全真模拟试题(八))氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的
键比
键稳定(填“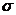 ”“
”“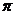 ”)。
”)。
(3)(CH3)3NH+和AlCl-4可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
 a.助燃剂
b.“绿色”溶剂
a.助燃剂
b.“绿色”溶剂
c.复合材料 d.绝热材料
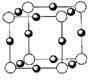
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成
的晶体结构如图所示。X的元素符号是 ,与同一个
N3-相连的X+有 个。
(5)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
(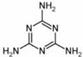 )。
)。
下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
[解析](1)基态N3-的电子排布式为1s22s22p6;(2)根据数据可以判断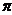 键比
键比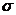 键稳定;(3)X+中所有电子正好充满K、L、M三个电子层,可以判断X为Cu,根据晶胞可以判断与同一个N3-相连的X+有6个;
键稳定;(3)X+中所有电子正好充满K、L、M三个电子层,可以判断X为Cu,根据晶胞可以判断与同一个N3-相连的X+有6个;
[答案] (1)1s22s22p6(2分) (2)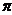
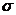 (1分) (3)小 b (2分)
(1分) (3)小 b (2分)
(4)Cu 6 (2分)(5)B(1分)
[考点分析]本题主要考查核外电子排布式的书写、共价键的稳定性、晶胞结构分析、杂化方式、溶解性、晶体熔点高低比较等知识点。
12.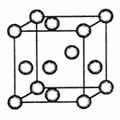 (山东省临清一中2009届高考理科综合全真模拟试题(十))铜合金是人类适用最早的金属材料,铜在化合物中常见的化合价有+1、+2价,能形成多种铜的化合物。
(山东省临清一中2009届高考理科综合全真模拟试题(十))铜合金是人类适用最早的金属材料,铜在化合物中常见的化合价有+1、+2价,能形成多种铜的化合物。
(1)基态铜原子的电子排布式为 ;铜晶体晶胞如
右图所示,该晶胞实际拥有 个铜原子。
(2)某+1价铜的配离子为[Cu(CN)4]3-,与其配体互为等电子体
的一种微粒是 。
(3)许多+1价铜的配合物溶液能吸收CO和烯烃(如C2H4、CH3CH=CH2等),CH3CH=CH2分子中C原子采取的杂化方式有 。
(4)在硫酸铜溶液中逐滴加入氨水至过理,观察到先出现蓝色沉淀,最后溶解形成深蓝色溶液,写出此蓝色沉淀溶解的离子方程式: ;根据价层电子对互斥模型,预测SO2-4的空间构型为 。
[解析](1)1s22s22p63s23p63d104s1或;[Ar]3d104s1 利用均摊法计算可得该晶胞实际拥有4个铜原子。(2)根据等电子体定义可以有CO、N、C2-2等;(3)CH3CH=CH2分子中CH3-中C的杂化为sp3,另外2个C为sp2杂化。(4)Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2-+2OH-+4H2O 正四面体形
[答案](1)1s22s22p63s23p63d104s1或;[Ar]3d104s1 4
(2)CO、N、C2-2(写出一种即可)
(3)sp2、sp3
(4)Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2-+2OH-+4H2O 正四面体形
[考点分析]本题主要考查核外电子排布式的书写、中心原子的杂化、等电子体、配合物、价层电子对互斥模型等知识点。
11.(青岛市2009年高三模拟练习5月)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层 只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 ;
 (3)A的最高价含氧酸根离子中,其中心原子采取 杂化,D的低价氧化物分子的空间构型是
。
(3)A的最高价含氧酸根离子中,其中心原子采取 杂化,D的低价氧化物分子的空间构型是
。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为 ;(每个球均表示1个 原子)
[解析]A原子核外有三个未成对电子,可以推断为N;A与B可形成离子化合物B3A2,可以推断B为Mg;C元素是地壳中含量最高的金属元素,即为Al;D原子核外的M层中有两对成对电子,可以推断D为S;E原子核外最外层只有1个电子,其余各层电子均充满,可以推断E为Cu。
[答案](1)1s22s22p63s23p63d104s1(或[Ar] 3d104s1) Al<Mg< S<N
(2)MgCl2为离子晶体而AlCl3为分子晶体 (3)sp2 ,V形 (4)Cu3N
[考点分析]本题考查核外电子排布式的书写、电离能大小比较、晶体熔点高低比较、中心原子的杂化及分子空间结构、均摊法计算微粒等知识点。
10.(天津市汉沽一中2009第五次月考)根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相似的是 ( )
A.CO和N2 B.O3和NO- C.CO2和N2O D.N2H4和C2H4
[解析]要吻合结构相似,就是去寻找互为等电子体的微粒,而D不吻合等电子体的要求。
[答案]D
[考点分析]本题主要考查等电子体的概念理解和应用。
9. (长春市实验中学2009届高三理科综合练习化学部分(四))下列事实与氢键有关的是
A. 水加热到很高的温度都难以分解
B. 水结成冰体积膨胀,密度变小
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D. HF、HCl、HBr、HI的热稳定性依次减弱
[解析]由于形成氢键使水分子间间隙增大,使体积增大,密度减小。
[答案]B
[考点分析]本题主要考查氢键对物质物理性质的影响。
8.(四川宜宾市第三中学校2009届高三上半期考试理科综合)下列对一些实验事实的理论解释正确的是
|
选项 |
实 验 事 实 |
理 论 解 释 |
|
A. |
SO2溶于水形成的溶液能导电 |
SO2是电解质 |
|
B. |
白磷为正四面体分子 |
白磷分子中P-P间的键角是109°28′ |
|
C. |
1体积水可以溶解700体积氨气 |
氨是极性分子且由于有氢键的影响 |
|
D. |
HF的沸点高于HCl |
H-F的键长比H-Cl的键长短 |
[解析]A中SO2本身不导电,是非电解质;B中白磷分子中P-P间的键角是60°;D中是由于HF分子间能形成氢键;
[答案]C
[考点分析]本题考查了键角、氢键、熔沸点影响因素等知识点。
7.(2008山东卷)下列说法正确的是
A . SiH4 比CH4 稳定
B .O2-半径比 F― 的小
C. Na 和 Cs属于第 IA 族元素, Cs 失电子能力比 Na 的强
D . P 和 As属于第 VA 族元素, H3PO4 酸性比 H3 AsO4的弱
[解析]A中由于Si的非金属性小于C,所以SiH4没有CH4 稳定;B中O2-和 F― 的核外电子排布相同,核电荷数越大,离子半径越小;D中同主族元素,自上而下非金属性减弱,所以H3PO4 酸性比 H3 AsO4的强。
[答案]C
[考点分析]本题主要考查元素周期律的相关知识。
6.(2008江苏卷)下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
[解析]根据非金属性:F>O>S,可以判断热稳定性的顺序为:HF>H2O>H2S,同理可以判断酸性:HClO4>H2SO4>H3PO4,所以①、③错误。根据原子在元素周期表中的位置及原子半径的规律可以判断②正确。根据溶液的酸碱性可以判断④正确。所以答案为B。
[答案]B
[考点分析]本题主要考查原子结构及周期律的基本知识。
5.(2009四川卷10).X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
A. 还原性:X的氢化物>Y的氢化物>Z的氢化物
B. 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C. YX2、M2Y都是含有极性键的极性分子
D. Z元素的最高价氧化物的水化物的化学式为HZO4
[解析]从题给信息可判断:X是O、Y是S、Z是Cl、M是K;A选项非金属性越强,氢化物的还原性越弱,所以A错;B选项电子层结构相同的离子核电荷数越大半径越小。C选项M2Y是离子化合物。
[答案]D
[考点分析]本题考查原子结构、元素的推断、元素周期律等知识。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com