
3.(山东庆云一中2009年高考考前热身训练)目前,全世界镍(Ni)的消费量仅次于铜、铝、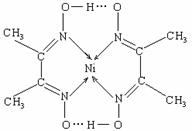 铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。
铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)某配合物结构如右图所示,分子内含有的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
 (3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③ ④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③ ④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序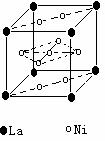 号),预测HCHO分子的立体结构为
形。
号),预测HCHO分子的立体结构为
形。
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是 。
[解析](1)根据其物理性质可以判断为分子晶体;Ni为28号元素,所以基态Ni原子的电子排布式为1s22s22p63s23p63d84s2或[Ar] 3d84s2;(3)平面结构的中心原子为sp2杂化,所以选①③④;(4)根据均摊法计算即可;
[答案](1)分子、1s22s22p63s23p63d84s2或[Ar] 3d84s2 (2)ACE
(3)①③④、平面三角 (4)LaNi5或Ni5La
2.(银川一中2009届高三年级第四次月考理综)
元素A-D是元素周期表中短周期的四种元素,请根据表中的信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
物质或结构信息 |
单质制成的的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 |
单质常温、常压下是气体,原子的L层有一个未成对的 电子 电子 |
+2价阳离子的核外电子排布与氖原子相同。 |
(1)上表中与A属于同一周期的元素是_____________(写元素符号) ,写出D离子的电子排布式______________________。
(2)D和C形成的化合物属于_________晶体 。写出C单质与水反应的化学方程式_________________________ 。
(3)对元素B的单质或化合物描述正确的是_________。
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是(写元素符号)__ ___。 写出能证明该结论的一个实验事实___________ _____。
[解析]A单质制成的的高压灯,发出的黄光透雾力强、射程远。A为Na;B工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构,B可能为N或O; C单质常温、常压下是气体,原子的L层有一个未成对的 电子,C为F;D+2价阳离子的核外电子排布与氖原子相同,D为Mg。
电子,C为F;D+2价阳离子的核外电子排布与氖原子相同,D为Mg。
[答案](1)Mg;
1s22s22s6。 (2)离子; 2F2+2H2O 4HF+O2.
4HF+O2.
(3)b;d(B是氧气或氮气)。
(4)Na;钠与水反应比镁与水反应激烈或氢氧化钠的碱性比氢氧化镁强
1.(天津市汉沽一中2008-2009学年度高三第四次月考)
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧( ) 和镍(
) 和镍( ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
 E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)

[解析](1)根据晶胞可以得到储氢材料的化学式为:LaNi5;(2)A中储氢材料中不存在共价键,不属于原子晶体;B中此过程吸热;D中氢气分子间不存在氢键;
[答案](1)LaNi5 + 3H2  LaNi5H6;(2)CE(3)①[Ar]3d7;或
LaNi5H6;(2)CE(3)①[Ar]3d7;或
②2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;
(4)A和B(或A和C、A和D、B和E、C和E、D和E任一组均可);
5.(山东省潍坊市2009届4月高三第二次模拟)X、Y、Z、W四种元素位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51。Y原子的L层P轨道中有2个电子,Z与Y原子的价层电子数相同,W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:l。
(1)Y与X形成只含一个中心原子的共价化合物a,该分子中的中心原子轨道采用 杂化成键,a分子的立体构型为 。
(2)Y的最高价氧化物和Z最高价氧化物的晶体类型分别是 晶体、_________晶体。
(3)x的氧化物与Y的氧化物中,分子极性较大的是(填分子式) 。
(4)Y与Z比较,电负性较大的是 (填元素符号)。
(5)w元素的名称是
, 离子的核外电子排布式是
。
离子的核外电子排布式是
。
[解析]Y原子的L层P轨道中有2个电子,得到Y为C;Z与Y原子的价层电子数相同,得到Z为Si;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:l,得到W为Zn;根据核电荷数之和为51,得到X为H。

[专题综合]
4.(2009届高考临清一中理科综合全真模拟化学试题(三)) 四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
T |
X |
Y |
Z |
|
性质 结构 信息 |
原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子式 ;写出Z元素原子的核外电子排布式: ;元素Y的原子核外共有______种形状不同的电子云。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式
(3)元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深 b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
[解析]T原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂,可以得到T位O;X单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼,可以得到X为N;Y单质质软、银白色固体、导电性强。
单质在空气中燃烧发出黄色的火焰。得到Y位Na;Z第三周期元素的简单离子中半径最小,得到Z为Al。
[答案]
 (1)
(1)
1S22S22P63S23P1 ; 2 种
(2)2Al + 2OH- + 2 H2O → 2 AlO2-+ 3 H2↑
(3) F b、c
3.(安徽省2009年省级示范高中高三第二次联考)下表给出了十种短周期元素的原子半径及主要化合价:
|
元素 代号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径/nm |
0.074 |
0.160 |
0.152 |
0.110 |
0.099 |
0.186 |
0.075 |
0.082 |
0.102 |
0.143 |
|
最高或最低化合价 |
-2 |
+2 |
+1 |
+5 -3 |
+7 -1 |
+1 |
+5 -3 |
+3 |
+6 -2 |
+3 |
(1)上述元素中,属于第2周期的元素共有 种。
(2)写出编号为⑨的原子的核外电子排布式 ;上述元素中第一电离能最小的是 (填元素符号)
(3)上述元素中,最高价氧化物对应水化物酸性最强的物质的化学式 ,最高价氧化物对应水化物与其氢化物能生成含离子键的元素是 (填编号)
(4)写出编号为⑥和⑩的两种元素最高价氧化物对应水化物反应的离子方程式:
。
(5)对编号为②和⑤的两种元素形成化合物的水溶液进行加热蒸干,写出该过程反应的化学方程式: 。
(6)上述元素中,有一种元素的单质是工业还原法冶炼金属的还原剂,写出该单质与铁的氧化物反应的化学方程式: 。
[解析]先根据最高或最低化合价确定主族,再根据原子半径确定周期及同周期中的位置,可以判断:①为O, ②为Mg, ③为Li,④为P, ⑤为Cl, ⑥为Na, ⑦为N, ⑧为B,⑨为S,⑩为Al。
[答案](1)四 ; (2)1s22s22p63s23p4 Na
(3)HClO4 ⑦ (4)Al(OH)3+OH- = AlO2- +2H2O (或Al(OH)3+OH- = Al(OH)4-)
(5)MgCl2+2H2O Mg(OH)2↓+2HCl↑
Mg(OH)2↓+2HCl↑
(6)Fe2O3 +2Al Al2O3 + 2
Fe (也可写另两种铁的氧化物与铝反应)
Al2O3 + 2
Fe (也可写另两种铁的氧化物与铝反应)
2.(2009届高考临清一中理科综合全真模拟化学试题(五))现有部分前四周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
第三周期中的半导体材料 |
|
B |
L层s电子数比p电子数少1 |
|
C |
第三周期主族元素中其第一电离能最大 |
|
D |
前四周期呀中其未成对电子数最多 |
(1)B单质分子中,含有________个 键和__________个
键和__________个 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
[解析]A为第三周期中的半导体材料,得出A为Si;B的L层s电子数比p电子数少1,得出B为N;C在第三周期主族元素中其第一电离能最大,为Cl;D在前四周期呀中其未成对电子数最多,所以为Cr.
[答案](1)1 2 ,三角锥形
(2)低于 Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高
(3)1s22s22p63s23p63d54s1
1.(2009年马鞍山市高中毕业班第三次教学质量检测)A、B、C、D是原子序数依次增大的四种短周期元素。请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质或结构信息 |
与同主族元素原子序数相差2 |
原子的最外层电子排布式为nsnnp2n-1 |
原子序数是A、B两元素原子序数之和的2倍 |
原子半径在所属周期中最小 |
(1)写出B原子的最外层轨道排布式______________________。
(2) A与B的单质可化合生成M,A与D的单质可化合生成N,M的空间构型为_____________。M与N可以在空气中化合生成E,E的电子式为____________________,写出在E溶于水所得的溶液中各离子浓度由大到小的顺序________________________。
(3)C的单质在空气中燃烧可生成气体F,写出F与A、C形成的化合物反应的方程式,并标出电子转移的方向和数目 _ ,F与A、B、D单质中的一种在溶液中充分反应可生成两种酸,写出该反应的离子方程式 。
[解析]A与同主族元素原子序数相差2,在短周期中只有H与Li差2,所以A为H;B原子的最外层电子排布式为nsnnp2n-1,n=2,所以B为N;C的原子序数是A、B两元素原子序数之和的2倍,所以C为S;D的原子半径在所属周期中最小,D在第三周期,所以为Cl。
 [答案
[答案 ]
]
(1)
(2)三角锥形,
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(3) SO2 +Cl2
+2H2O = 4H+ + SO42- + 2Cl-
SO2 +Cl2
+2H2O = 4H+ + SO42- + 2Cl-
[考点分析]本题主要考查学生对元素周期表的熟练程度以及半径大小规律,在此基础上推导元素,结合问题考查轨道表示式、空间构型、电子式书写、离子浓度大小比较、单线桥的表示、离子反应的书写。
16.(2009安徽卷25)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O的黑色的ZO两种氧化物。
(1)W位于元素周期表第 周期第 族。W的气态氢化物稳定性比H2O(g) (填“强”或“弱” )。
(2)Y的基态原子核外电子排布式是 ,Y的第一电离能比X的 (填“大”或“小” )。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是 。
(4)已知下列数据:




X的单质和FeO反应的热化学方程式是 。
[解析]W、Y的氧化物是导致酸雨的主要物质,所以W为N、Y为S;X的基态原子核外有7个原子轨道填充了电子,结合 ,可以得到X为Al;Z能形成红色(或砖红色)的Z2O的黑色的ZO两种氧化物,得到Z为Cu。
,可以得到X为Al;Z能形成红色(或砖红色)的Z2O的黑色的ZO两种氧化物,得到Z为Cu。
[答案](1)二 ⅤA 弱 (2)1s22s22p63s23p4 大
(3)Cu+2H2SO4 (浓)  CuSO4 +SO2↑+2H2O
CuSO4 +SO2↑+2H2O
 (4)2Al(s)+3FeO(s) 3Fe(s)+Al2O3(s) ⊿H=-859.7KJ ·mol-1
(4)2Al(s)+3FeO(s) 3Fe(s)+Al2O3(s) ⊿H=-859.7KJ ·mol-1
[考点分析]本题考查元素在元素周期表中的位置、氢化物稳定性比较、基态原子核外电子排布、电离能比较、化学反应方程式书写、热化学反应方程式书写等知识。
[专题突破]
15. (2009全国1卷29)
(2009全国1卷29) 已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
 (1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是
;
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是
;
 (2)Q的具有相同化合价且可以相互转变的氧化物是
;
(2)Q的具有相同化合价且可以相互转变的氧化物是
;
 (3)R和Y形成的二价化合物中,R呈现最高化合价的化合物是化学式是
;
(3)R和Y形成的二价化合物中,R呈现最高化合价的化合物是化学式是
;
 (4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)
,其原因是
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)
,其原因是
 ②电子总数相同的氢化物的化学式和立体结构分别是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
 (5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是

 [解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。Y为O,所以R的最高价化合物应为SO3。(4)显然D为P元素。①氢化物沸点顺序为NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O的电子数均为10,结构分别为三角锥和V形,SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
[解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。Y为O,所以R的最高价化合物应为SO3。(4)显然D为P元素。①氢化物沸点顺序为NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O的电子数均为10,结构分别为三角锥和V形,SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
 [答案](1)原子晶体。(2)NO2和N2O4(3)SO3。(4)①NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O分别为三角锥和V形;SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4
= 8NH3 + Si3N4
[答案](1)原子晶体。(2)NO2和N2O4(3)SO3。(4)①NH3>PH3,H2O>H2S,因为前者中含有氢键。②NH3和H2O分别为三角锥和V形;SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4
= 8NH3 + Si3N4
[考点分析]本题考查学生结合问题进行元素推断的能力,同时考查晶体类型的判断、氢化物沸点高低比较、分子空间结构、根据信息书写化学反应的能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com