
29. 尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出两条合成路线)。
尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出两条合成路线)。

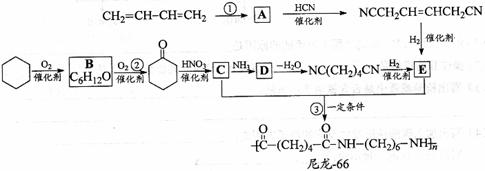
 完成下列填空:
完成下列填空:
 (1)写出反应类型:反应②__________________反应③___________________________
(1)写出反应类型:反应②__________________反应③___________________________
 (2)写出化合物D的结构简式:_______________________________________________
(2)写出化合物D的结构简式:_______________________________________________
 (3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:

 ____________________________________________________________________________
____________________________________________________________________________
 (4)写出反应①的化学方程式:
(4)写出反应①的化学方程式:

 ____________________________________________________________________________
____________________________________________________________________________
 (5)下列化合物中能与E发生化学反应的是_________。
(5)下列化合物中能与E发生化学反应的是_________。
 a.
a.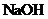 b.
b.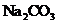 c.
c.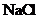 d.
d.
 (6)用化学方程式表示化合物B的另一种制备方法(原料任选):
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):
 ____________________________________________________________________________
____________________________________________________________________________
答案:
 (1)氧化反应 缩聚反应
(1)氧化反应 缩聚反应
 (2)
(2)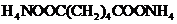
 (3)
(3)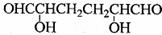 (合理即给分)
(合理即给分)
 (4)
(4)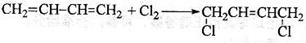
 (5) d
(5) d
 (6)
(6) (合理即给分)
(合理即给分)
解析:结合题目信息再采用逆推法,由尼龙-66的结构简式可推知C为:HOOC-(CH2)4-COOH,E为H2N-(CH2)6-NH2。反应①是发生了1,4-加成反应,故反应①的化学方程式为:

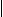 CH2=CH-CH=CH2+Cl2→CH2-CH=CH-CH2.由C到D为已二酸与氨气生成铵盐,故D为H4NOOC(CH2)4-COONH4。
Cl
Cl
CH2=CH-CH=CH2+Cl2→CH2-CH=CH-CH2.由C到D为已二酸与氨气生成铵盐,故D为H4NOOC(CH2)4-COONH4。
Cl
Cl

 C为已二酸,与C互为同分异构体且能发生银镜反应的物质中必含有醛基,一个羟基可用一个醛基和一个羟基代替,故可写为:OHC-CH-CH2-OHCH2-CH-CHO。E中含有碱性基团-NH2,故可与HCl发生反应。
OH
OH
C为已二酸,与C互为同分异构体且能发生银镜反应的物质中必含有醛基,一个羟基可用一个醛基和一个羟基代替,故可写为:OHC-CH-CH2-OHCH2-CH-CHO。E中含有碱性基团-NH2,故可与HCl发生反应。
OH
OH
28. 环氧氯丙烷是制备树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件)。
环氧氯丙烷是制备树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件)。

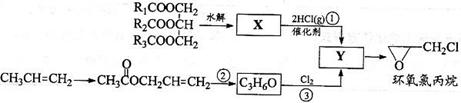
 完成下列填空:
完成下列填空:
 (1)写出反应类型:反应①_________________ 反应③___________________
(1)写出反应类型:反应①_________________ 反应③___________________
 (2)写出结构简式:X_____________________ Y________________________
(2)写出结构简式:X_____________________ Y________________________
 (3)写出反应②的化学方程式:______________________________________________
(3)写出反应②的化学方程式:______________________________________________
 (4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含
(4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含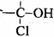 及
及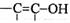 结构)
结构)
 有__________种。
有__________种。
答案:
 (1)取代反应 加成反应
(1)取代反应 加成反应
 (2)
(2)
 (3)
(3)
 (4)3
(4)3





 [解析]反应②中生成的C3H6O的结构简式为CH2===CHCH2OH,与Cl2发生加成反应得到Y:CH2-CH-CH2,所以X(CH2CHCH2)生成Y的反应为取代反应。
[解析]反应②中生成的C3H6O的结构简式为CH2===CHCH2OH,与Cl2发生加成反应得到Y:CH2-CH-CH2,所以X(CH2CHCH2)生成Y的反应为取代反应。
Cl Cl OH OH OHOH
(4)环氧氯丙烷分子中有1个不饱和度,其同分异构体应有一个双键或一个环,结合题目的限制条件可知,有如下三种情况:

 CH==CH-CH2OH CH2==C-CH2OH
CH==CH-CH2OH CH2==C-CH2OH
Cl Cl
 CH2-CH-OH
CH2-CH-OH

 CH
CH
Cl
27. 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

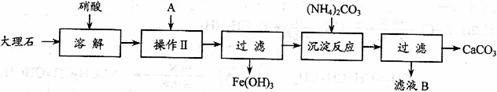
 (1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
(1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
 (2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
 (3)写出检验滤液中是否含铁离子方程式:_____________________________________
(3)写出检验滤液中是否含铁离子方程式:_____________________________________
 ______________________________________________________________________。
______________________________________________________________________。
 (4)写出加入碳酸铵所发生反应的离子方程式:________________________________
(4)写出加入碳酸铵所发生反应的离子方程式:________________________________
 写出滤液B的一种用途:_________________________
写出滤液B的一种用途:_________________________
 (5)
(5)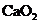 中一般含
中一般含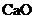 。试按下列提示完成
。试按下列提示完成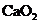 含量分析的实验设计。
含量分析的实验设计。
 试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
 实验步骤:
实验步骤:
 ①_______;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
①_______;②加入_________________;③加入酚酞,用氢氧化钠标准溶液滴定。
 (6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为______________
答案:
 (1)硫酸钙微溶于水
(1)硫酸钙微溶于水
 (2)除去溶液中
(2)除去溶液中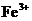 氨水
氨水
 (3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含
(3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含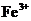 ;
; 或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含
或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含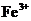
 (4)
(4)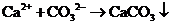 作化肥(合理即给分)
作化肥(合理即给分)
 (5)称量 过量的标准盐酸
(5)称量 过量的标准盐酸
 (6)0.1%
(6)0.1%
[解析](2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去[Fe(OH)3在弱酸性环境下就能沉淀],由因为要求溶液A的溶质是共价化合物,所以A应为氨水。(4)滤液B的溶质是NH4NO3,可以用作化肥。
(6)半滴的体积为1/50mL,则相对误差为 ×100%=0.1%
×100%=0.1%
26. 根据硫化氢气体的实验室制法和性质完成下列填空。
根据硫化氢气体的实验室制法和性质完成下列填空。
 (1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用________。
 a.稀硫酸与硫化亚铁
b.稀硝酸与硫化亚铁
a.稀硫酸与硫化亚铁
b.稀硝酸与硫化亚铁
 c.稀硫酸与硫化钠
d.稀盐酸与硫化亚铁
c.稀硫酸与硫化钠
d.稀盐酸与硫化亚铁
 (2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;

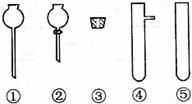 ______________(填编号)。
______________(填编号)。


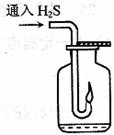



 (3)如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
(3)如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
 点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察到
 的现象是___________________________________________________。
的现象是___________________________________________________。
 (4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
 ______________________________________________________________
______________________________________________________________
 反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。
反应过程中,溶液的pH______(填“变大”、“变小”或“不变”)。
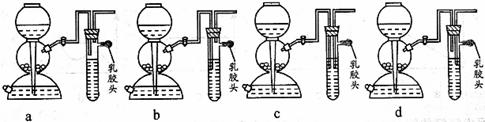
 (5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。

 (6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
(6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______________________。
答案:
 (1)a d
(1)a d
 (2)② ③ ④
(2)② ③ ④
 (3)品红溶液褪色;瓶壁有淡黄色粉末和无色的小液滴
(3)品红溶液褪色;瓶壁有淡黄色粉末和无色的小液滴
 (4)
(4) 变大
变大
 (5)b
(5)b
 (6)S H2O
(6)S H2O
[解析](1)若用启普发生器制取气体,所选试剂应为块状固体和液体,且反应不需要加热,故a、d正确,c错误。硝酸具有强氧化性,与硫化亚铁反应得不到H2S,b项错。
(2)要控制硫化氢气体产生速率必须选用分液漏斗。
(3)开始氧气充足,H2S燃烧生成SO2和H2O,后来氧气不足,燃烧产物为S和H2O,描述反应现象要从SO2、S和H2O三个方面考虑。
(5)a中增加的装置起不到任何作用。b装置可将启普发生器内的H2S与点燃的H2S分隔开,能防止爆炸。c、d装置中生成的H2S无法排出,故错误。
(6)当硫化氢在空气中的体积分数为30%时,O2在混合气体中的体积分数为70%×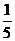 =14%,O2不足,发生反应2H2S+O2
=14%,O2不足,发生反应2H2S+O2 2S+2H2O。
2S+2H2O。
0.3mol 11.2g
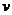 (CO)=
(CO)=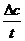 =0.3mol/(2L×10min)=0.015mol·L-1·min-1
=0.3mol/(2L×10min)=0.015mol·L-1·min-1
(2)可逆反应平衡的根本特征是V(正)=V(逆),其表现为反应物和生成物的浓度、质量、百分含量不随时间变化,注意不能考虑固态或纯液态的物质。前后体积变化的可逆反应还可通过压强来判断是否平衡,若反应中含有有色气体,还可通过气体的颜色变化来判断。
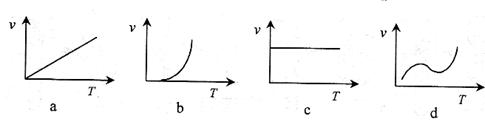
(3)根据温度升高,反应速率增大,图像b正确,注意二者并非正比例关系,a项不正确。
(4)Al(OH)3是两性氢氧化物,其酸式电离的离子方程式为:Al(OH)3 H++AlO2-+H2O;碱式电离的离子方程式为:Al(OH)3===Al3++3OH-,欲使Al3+浓度增大,可加入盐酸、硫酸等以降低OH-浓度,使平衡向碱式电离的方向移动。
H++AlO2-+H2O;碱式电离的离子方程式为:Al(OH)3===Al3++3OH-,欲使Al3+浓度增大,可加入盐酸、硫酸等以降低OH-浓度,使平衡向碱式电离的方向移动。
25. 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。

 (1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:

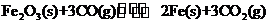
 ①该反应的平衡常数表达式为:K=
①该反应的平衡常数表达式为:K=
 ②该温度下,在2L盛有
②该温度下,在2L盛有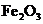 粉末的密闭容器中通入CO气体,10min后,生成了单
粉末的密闭容器中通入CO气体,10min后,生成了单
 质铁11.2g。则10min内CO的平均反应速率为
质铁11.2g。则10min内CO的平均反应速率为
 (2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
 ①
②
①
②
 (3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
 和温度(T)的关系示意图中与铝热反应最接近的是
。
和温度(T)的关系示意图中与铝热反应最接近的是
。

 (4)写出氢氧化铝在水中发生酸式电离的电离方程式:
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:
 欲使上述体系中
欲使上述体系中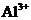 浓度增加,可加入的物质是
。
浓度增加,可加入的物质是
。
答案:
 (1)
(1)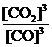

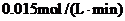
 (2)①CO或(CO2)的生成速率与消耗速率相等;②CO(或CO2)的质量不再改变
(2)①CO或(CO2)的生成速率与消耗速率相等;②CO(或CO2)的质量不再改变
 (合理即给分)
(合理即给分)
 (3) b
(3) b
 (4)
(4)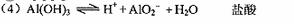 (合理即给分)
(合理即给分)
[解析](1)Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
3mol 2×56g
24. 某反应中反应物与生成物有:
某反应中反应物与生成物有: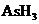 、
、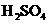 、
、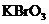 、
、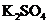 、
、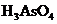 、
、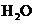 和一种未知物质X。
和一种未知物质X。
 (1)已知
(1)已知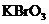 在反应中得到电子,则该反应的还原剂是
。
在反应中得到电子,则该反应的还原剂是
。
 (2)已知0.2mol
(2)已知0.2mol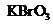 在反应中得到1mol电子生成X,则X的化学式为
。
在反应中得到1mol电子生成X,则X的化学式为
。
 (3)根据上述反应可推知
。
(3)根据上述反应可推知
。
 a.氧化性:
a.氧化性: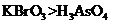 b.氧化性:
b.氧化性: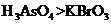
 c.还原性:
c.还原性: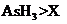 d.还原性:
d.还原性: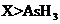
 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
 向和数目:
向和数目:

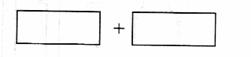
答案:
 (1)AsH3
(1)AsH3
 (2)Br2
(2)Br2
 (3)a c
(3)a c
 (4)
(4)
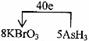
[解析](1)KBrO3在反应中得到电子,则另外一种化合价变化的元素在反应中失去电子被氧化,所给物质中As元素化合价发生了变化,低价态的AsH3是还原剂。
(2)0.2mol KBrO3得到1mol电子,说明Br元素在反应中降低了5价,所以x的化学式为Br2。
(4)利用氧化还原反应中电子得失相等的规律可配平该方程式为

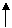 8KBrO3+5AsH3+4H2SO4===4K2SO4+4Br2+5H3AsO4+4H2O
8KBrO3+5AsH3+4H2SO4===4K2SO4+4Br2+5H3AsO4+4H2O

|


23. 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
 (1)在光照条件下,氯气和氢气反应过程如下:
(1)在光照条件下,氯气和氢气反应过程如下:
 ①
①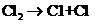 ②
②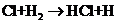 ③
③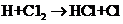 ……
……
 反应②中形成的化合物的电子式为
;反应③中被破坏的化学键属
反应②中形成的化合物的电子式为
;反应③中被破坏的化学键属
 于
键(填“极性”或“非极性”)。
于
键(填“极性”或“非极性”)。
 (2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
 (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
 (3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
 a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
 b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
 c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
 d.卤素单质与氢气化合按
d.卤素单质与氢气化合按 、
、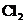 、
、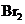 、
、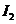 的顺序由难变易
的顺序由难变易

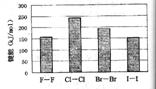 (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:
 ①非金属性强的卤素,其单质分子的化学键
①非金属性强的卤素,其单质分子的化学键
 断裂(填“容易”或“不容易”或“不一定容易”)。
断裂(填“容易”或“不容易”或“不一定容易”)。
 ②卤素单质键能大小与键长的关系为:
②卤素单质键能大小与键长的关系为:

答案:
(1)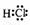 非极性
非极性
 (2)S Cl F 三 IA
(2)S Cl F 三 IA
 (3)a
(3)a
 (4)①不一定容易 ②除F2外,键长增长,键能减小 (合理即给分)
(4)①不一定容易 ②除F2外,键长增长,键能减小 (合理即给分)
[解析](1)同一元素组成的双原子分子为非极性分子,不同种元素组成的分子为极性分子,HCl分子中共用一对电子,可直接写出。
(2)短周期主族元素中与氯元素相邻的有F和S,根据同周期和同主族元素原子的半径变化规律可知,三者的原子半径从大到小的顺序是S>Cl>F。与氯同周期,金属性最强的元素位于该周期的最左侧,为Na元素。
(3)随着原子半径增大,卤代氢的键长逐渐增大,b项错误。自上而下,卤代氢的还原性依次增强,C项错误。卤素单质与氢气化合的难易取决于卤素非金属性的强弱,自上而下为由易到难,D错。
22. 实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所
实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所
 得固体中含金属单质为18g,则该氧化物粉末可能是
得固体中含金属单质为18g,则该氧化物粉末可能是
 A.
A.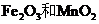 B.
B.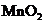 和
和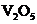 C.
C.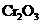 和
和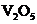 D
D 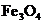 和FeO
和FeO
答案:AD
[解析]9 g铝粉可以提供1mol电子,则氧化物中的金属元素每得到1mol电子对应的质量就应该是18g。 三价Fe得到1mol电子对应的质量为18.7g,四价Mn得到1mol电子对应的质量为13.8g,故A项正确。五价V得到1mol电子对应的质量为10.2g,三价 Cr得到1mol电子对应的质量为17.3g, B、C两项即使9g铝粉全部反应,所得金属单质的质量也不到18g,故都错误。Fe3O4中的铁元素得到1mol电子对应的质量为21g,二价Fe得到1mol电子对应的质量为28g,当铝粉不足时, D项正确。


 上海化学试卷
上海化学试卷
 本试卷分为第Ⅰ卷(第1-4页)和第Ⅱ卷(第5-10页)
本试卷分为第Ⅰ卷(第1-4页)和第Ⅱ卷(第5-10页)
 两部分。全卷共10页。满分150分,考试时间120分钟。
两部分。全卷共10页。满分150分,考试时间120分钟。
 第Ⅱ卷(共84分)
第Ⅱ卷(共84分)
 考生注意:
考生注意:
 1.答第Ⅱ卷前,考生务必将姓名、准考证号、校验码等填写清楚。
1.答第Ⅱ卷前,考生务必将姓名、准考证号、校验码等填写清楚。
 2.第Ⅱ卷从第23题到第31题,考生应用钢笔或圆珠笔将答案直接写在试卷上。
2.第Ⅱ卷从第23题到第31题,考生应用钢笔或圆珠笔将答案直接写在试卷上。
21. 下列坐标图所表示的量的关系错误的是
下列坐标图所表示的量的关系错误的是


 烷烃分子中碳原子数x与
烷烃分子中碳原子数x与 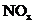 溶于水完全转化
氯化钠溶液中加水的量x 酒精水溶液中海清的
溶于水完全转化
氯化钠溶液中加水的量x 酒精水溶液中海清的
 碳的质量分数y的关系 为硝酸,x与消耗氧气 与溶质的质y的关系 质量分数x与酒精水
碳的质量分数y的关系 为硝酸,x与消耗氧气 与溶质的质y的关系 质量分数x与酒精水
 的量y的关系 溶液密度y的关系
的量y的关系 溶液密度y的关系
 A B C D
A B C D
答案:C
[解析 ]烷烃的分子可表示为CnH2n+2,烷烃分子中碳元素的质量分数可表示为12n/(14n+2),A项正确。以NOx的形式写出生成HNO3的总反应式:4NOx+2H2O+(5-2x)O2===4HNO3,其函数式为y=5-2x,B项正确。向氯化钠溶液中加水,溶液质量分数减小,但是溶质的质量不变,故C项错。酒精溶液随其浓度的增大,密度逐渐减小,D项正确。
]烷烃的分子可表示为CnH2n+2,烷烃分子中碳元素的质量分数可表示为12n/(14n+2),A项正确。以NOx的形式写出生成HNO3的总反应式:4NOx+2H2O+(5-2x)O2===4HNO3,其函数式为y=5-2x,B项正确。向氯化钠溶液中加水,溶液质量分数减小,但是溶质的质量不变,故C项错。酒精溶液随其浓度的增大,密度逐渐减小,D项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com