
5. 化学在生产和日常生活中有着重要的应用。下列说法不正确的是
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
 A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
 B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
 C.
C. 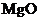 的熔点很高,可用于制作耐高温材料
的熔点很高,可用于制作耐高温材料
 D. 点解
D. 点解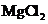 饱和溶液,可制得金属镁
饱和溶液,可制得金属镁
 [标准答案]D
[标准答案]D
 [解析]A项,明矾净水的原理是
[解析]A项,明矾净水的原理是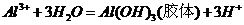 ,利用
,利用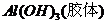 的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解
的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解 饱和溶液,发生地化学反应为
饱和溶液,发生地化学反应为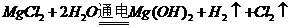 ,不会产生金属镁,电解熔融的
,不会产生金属镁,电解熔融的 能制取单质镁,发生的反应
能制取单质镁,发生的反应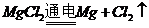 。
。
 [考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式
[考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式
4. 用NA表示阿伏加德罗常数的值。下列叙述正确的是
用NA表示阿伏加德罗常数的值。下列叙述正确的是
 A. 25℃时,PH=13的1.0L Ba(OH)2溶液中含有的
A. 25℃时,PH=13的1.0L Ba(OH)2溶液中含有的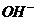 数目为0.2NA
数目为0.2NA
 B. 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
B. 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
 C. 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
C. 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
 D. 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
D. 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
 [标准答案]C
[标准答案]C
 [解析]A项,PH=13也就是意味着
[解析]A项,PH=13也就是意味着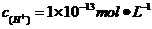 ,则
,则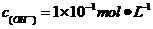 ,所以
,所以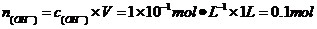 ,所以
,所以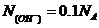 ;B项,发生的化学反应方程式为
;B项,发生的化学反应方程式为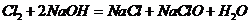 (该反应为歧化反应),
(该反应为歧化反应),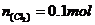 ,那么转移电子的数目应该为
,那么转移电子的数目应该为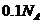 ;C项,乙烯和丁烯的最简式都是
;C项,乙烯和丁烯的最简式都是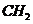 ,则
,则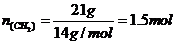 ,所以
,所以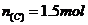 ,
,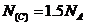 ;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是
;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是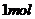 ,则所含有的氧原子个数也不为
,则所含有的氧原子个数也不为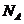 。
。
 [考点分析]以阿伏伽德罗常数为载体考察如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算;③正确表示一定物质的量的某物质微粒所含某种微粒的个数;④考查在标准状况下一定体积的气体分子所含的分子数和原子数。
[考点分析]以阿伏伽德罗常数为载体考察如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算;③正确表示一定物质的量的某物质微粒所含某种微粒的个数;④考查在标准状况下一定体积的气体分子所含的分子数和原子数。
3.
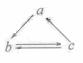 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
|
|
a |
b |
c |
|
A |
Al |
AlCl3 |
Al(OH)3 |
|
B |
HNO3 |
NO |
NO2 |
|
C |
Si |
SiO2 |
H2SiO3 |
|
D |
CH2=CH2 |
CH3CH2OH |
CH3CHO |
[标准答案]B
 [解析]A项:
[解析]A项: (
(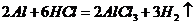 或者
或者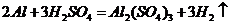 ,
,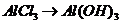 (
(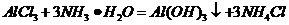 ),
),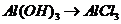 (
(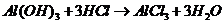 ),
),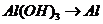 的转化必须经过
的转化必须经过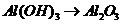 (反应方程式为:
(反应方程式为: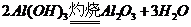 )和
)和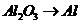 (
(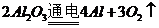 )这两步,所以A项不选;
)这两步,所以A项不选;
 B项:
B项: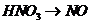 (
(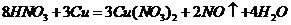 ),
),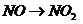 (
(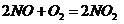 ),
),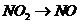 (
(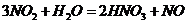 ),
),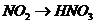 (
(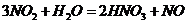 ),所以B项正确;
),所以B项正确;
 C项:
C项: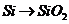 (
(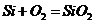 ),
),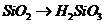 必须经过两步(
必须经过两步(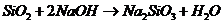 和
和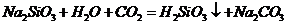 ),
),
 D项:
D项: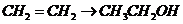 (
(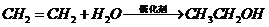 ),
),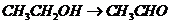 (
(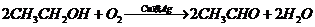 ),
),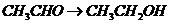 (
( ),
),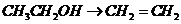 就必须经过两步(
就必须经过两步( 和
和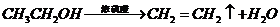 )
)
 [考点分析]熟练掌握元素及其化合物之间的转化关系
[考点分析]熟练掌握元素及其化合物之间的转化关系

2.  下列有关化学用语使用正确的是
下列有关化学用语使用正确的是
A. 硫原子的原子结构示意图:
B.NH4Cl的电子式: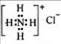
C.原子核内有10个中子的氧原子:
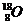
 D.对氯甲苯的结构简式:
D.对氯甲苯的结构简式: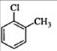
 [标准答案]C
[标准答案]C
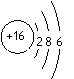
 [解析]A项,硫原子的原子结构示意图应为
[解析]A项,硫原子的原子结构示意图应为
 所以A项错误,B项,
所以A项错误,B项, 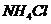 是由
是由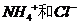 离子构成,由于
离子构成,由于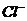 是阴离子,必须写出电子式,
是阴离子,必须写出电子式,
 C项,
C项,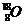 表示质量数为18,质子数为8的氧原子,所以该原子核内有10个中子
表示质量数为18,质子数为8的氧原子,所以该原子核内有10个中子
 D项,该结构简式是邻氯甲苯,因为氯原子和甲基的位置在相邻的碳原子上。对氯甲苯中的氯原子和甲基的位置应该处于相对位置。
D项,该结构简式是邻氯甲苯,因为氯原子和甲基的位置在相邻的碳原子上。对氯甲苯中的氯原子和甲基的位置应该处于相对位置。
 [考点分析]
[考点分析]
 ①熟记1-20号原子的原子结构结构示意图,常见阴离子、阳离子的结构示意图;
①熟记1-20号原子的原子结构结构示意图,常见阴离子、阳离子的结构示意图;
 ③质量数、质子数、中子数之间的关系;、
③质量数、质子数、中子数之间的关系;、
 ④常见有机物的命名。
④常见有机物的命名。

1. 《中华人民共和国食品安全法》于2009年月1日起实施。下列做法不利于平安全的是
A.用聚氯乙烯塑料袋包装食品
B. 在食品盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
[标准答案]A
[解析]A项,聚氯乙烯有毒,不能用于塑料袋包装食品,要用只能用聚乙烯,故选A项;B项,碘单质有毒而且易升华,碘化钾有苦味而且不稳定,容易被氧化成有毒的碘单质,碘酸钾是一种稳定易吸收的盐,故选择碘酸钾才作为最理想的添加剂,我们食用的食盐通常加的都是碘酸钾;C项,我国食品卫生法规定,食品添加剂是指为改善食品品质和色、香、味以及为防腐和加工工艺的需要而加入食品中的化学合成或天然物质。食品营养强化剂也属于食品添加剂。食品添加剂的好处首先是有利于食品保藏,防止食品腐烂变质。食品添加剂还能改善食品的感官性状,满足人们口感的要求。适当使用着色剂、食用香料以及乳化剂、增稠剂等食品添加剂,可明显提高食品的感官质量。保持、提高食品的营养价值是食品添加剂又一重要作用。国内外对食品添加剂都有严格规定和审批程序。只要严格按照国家批准的品种、范围、计量使用添加剂,安全才有保障 。 D项,高效、低毒、低残留农药是现代农药发展的一个方向。
[考点分析]本题考查了如下知识点
①化学物质与生活得关系。②食品添加剂。③化肥,农药对人类生活的影响
20. (10分)甲酸甲酯水解反应方程式为:
(10分)甲酸甲酯水解反应方程式为:

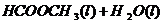

 某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:


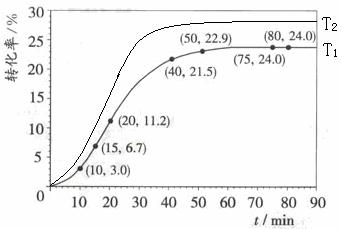
 甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

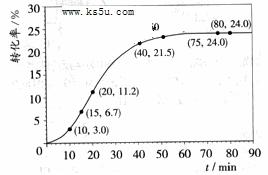

 (1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:


 请计算15~20min范围内甲酸甲酯的减少量为
mol,甲酸甲酯的平均反应速率
请计算15~20min范围内甲酸甲酯的减少量为
mol,甲酸甲酯的平均反应速率
 为 mol·min-1(不要求写出计算过程)。
为 mol·min-1(不要求写出计算过程)。
 (2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
。
 (3)上述反应的平衡常数表达式为:
(3)上述反应的平衡常数表达式为: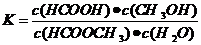 ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
 (4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
 [答案](1)0.045 9.0×10-3
[答案](1)0.045 9.0×10-3
 (2)该反应中甲酸具有催化作用
(2)该反应中甲酸具有催化作用
 ①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢。
①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢。
 ②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大。
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大。
 ③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。
 (3)0.14
(3)0.14
 (4)
(4)
 [解析](1)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1-1.00mol×6.7%==0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1-1.00mol×11.2%==0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol-0.888mol=0.045mol,则甲酸甲酯的平均速率==0.045mol/5min==0.009mol·min-1。
[解析](1)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1-1.00mol×6.7%==0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1-1.00mol×11.2%==0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol-0.888mol=0.045mol,则甲酸甲酯的平均速率==0.045mol/5min==0.009mol·min-1。
19. (12分)
(12分)
 某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。

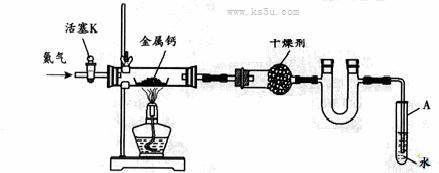

 (1)按图连接好实验装置。检查装置的气密性,方法是
。
(1)按图连接好实验装置。检查装置的气密性,方法是
。
 (2)反应过程中末端导管必须插入试管A的水中,目的是 。
(2)反应过程中末端导管必须插入试管A的水中,目的是 。
 (3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
 (4)数据记录如下:
(4)数据记录如下:


 ① 计算得到实验式CaxN2,其中x=
.
① 计算得到实验式CaxN2,其中x=
.
 ② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
[命题意图]考查考生化学实验基本操作技能和处理问题的能力,以及对试验结果进行计算和误差分析判断的能力
 [答案](1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好。
[答案](1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好。
 (2)防止反应过程中空气进入反应管;便于观察N2的流速
(2)防止反应过程中空气进入反应管;便于观察N2的流速
 (3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K。
(3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K。
 (4)①2.80
(4)①2.80
②O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2。若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以n(Ca)/n(N)<3/2,即x<3。
 [解析](1)见答案;(2)要保证整个装置不能混入其他气体;(3)一定要使玻璃管冷却后再停止通入气流;(4)要确定X值必须求出钙和氮的原子个数比根据题目给的数据可做如下计算①m(Ca)=(15.08-14.80)g=0.28g,m(N)= (15.15-15.08)g=0.07g,则n(Ca):n(N)=
:=7:5,则x=;②若通入的N2中混有少量O2,则产物中就有可能混有了CaO,而Ca3N2中钙的质量分数为81.08﹪,CaO中钙的质量分数为71.43﹪,所以产物中混有了CaO会导致钙的质量分数减小,x的值偏小。
[解析](1)见答案;(2)要保证整个装置不能混入其他气体;(3)一定要使玻璃管冷却后再停止通入气流;(4)要确定X值必须求出钙和氮的原子个数比根据题目给的数据可做如下计算①m(Ca)=(15.08-14.80)g=0.28g,m(N)= (15.15-15.08)g=0.07g,则n(Ca):n(N)=
:=7:5,则x=;②若通入的N2中混有少量O2,则产物中就有可能混有了CaO,而Ca3N2中钙的质量分数为81.08﹪,CaO中钙的质量分数为71.43﹪,所以产物中混有了CaO会导致钙的质量分数减小,x的值偏小。
 [考点分析]考查学生化学实验基本操作技能和处理问题的能力,以及对实验结果进行计算和误差分析判断的能力。
[考点分析]考查学生化学实验基本操作技能和处理问题的能力,以及对实验结果进行计算和误差分析判断的能力。

18.
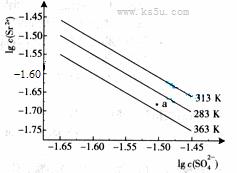
 硫酸锶(SrSO4)在水中的深沉溶解平衡曲线如下。下列说法正确的是
硫酸锶(SrSO4)在水中的深沉溶解平衡曲线如下。下列说法正确的是
 A.温度一定时,Ksp(SrSO4)随
A.温度一定时,Ksp(SrSO4)随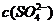 的增大而减小
的增大而减小
 B.三个不同温度中,313K时Ksp(SrSO4)最大
B.三个不同温度中,313K时Ksp(SrSO4)最大
 C.283K时,图中a点对应的溶液是不饱和溶液
C.283K时,图中a点对应的溶液是不饱和溶液
 D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液


 [答案]BC
[答案]BC
 [解析]Ksp只与温度有关,A错;由图像可知:在相同条件下,温度越低,
[解析]Ksp只与温度有关,A错;由图像可知:在相同条件下,温度越低,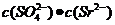 越大,Ksp(SrSO4)越大,B正确;a点在283K的下方,属于不饱和溶液,C正确;283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,D错。
越大,Ksp(SrSO4)越大,B正确;a点在283K的下方,属于不饱和溶液,C正确;283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,D错。
 [考点分析]考查沉淀溶解平衡及Ksp
[考点分析]考查沉淀溶解平衡及Ksp
17. 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
 2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
 A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
 B.在H2O2分解过程中,溶液的pH逐渐下降
B.在H2O2分解过程中,溶液的pH逐渐下降
 C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
 D.H2O2生产过程要严格避免混入Fe2+
D.H2O2生产过程要严格避免混入Fe2+
 [答案]CD
[答案]CD
 [解析]结合A、B两个方程式根据 氧化性、还原性强弱比较规律:得 H2O2的氧化性>Fe3+的氧化性, H2O2的还原性>Fe2+的还原性,A错;2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,H2O2分解Fe3+或Fe2+作催化剂,所以总量不变。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
[解析]结合A、B两个方程式根据 氧化性、还原性强弱比较规律:得 H2O2的氧化性>Fe3+的氧化性, H2O2的还原性>Fe2+的还原性,A错;2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,H2O2分解Fe3+或Fe2+作催化剂,所以总量不变。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
 [考点分析]考查氧化还原知识。
[考点分析]考查氧化还原知识。

16. 磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
 A.H3PW12O40在该酯化反应中其催化作用
A.H3PW12O40在该酯化反应中其催化作用
 B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
 C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团
 D.硅钨酸H4 SiW12O40也是一种杂多酸,其中W的化合价为+8
D.硅钨酸H4 SiW12O40也是一种杂多酸,其中W的化合价为+8
 [答案]D
[答案]D
 [解析]根据题意,“H3PW12O40等杂多酸可代替浓硫酸”可类推, H3PW12O40在酯化反应中也起催化作用,A正确;我们所学的钠盐都是强电解质可以大胆判断B正确;C项可以进行观察比较得出答案。硅钨酸H4 SiW12O40
中根据化合价代数和为零推出W的化合价为+6,D错。
[解析]根据题意,“H3PW12O40等杂多酸可代替浓硫酸”可类推, H3PW12O40在酯化反应中也起催化作用,A正确;我们所学的钠盐都是强电解质可以大胆判断B正确;C项可以进行观察比较得出答案。硅钨酸H4 SiW12O40
中根据化合价代数和为零推出W的化合价为+6,D错。
 [考点分析]根据已有的的知识结合题目信息进行类推比较。
[考点分析]根据已有的的知识结合题目信息进行类推比较。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com