
14. (8分)
(8分)



 汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
 (1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为 ,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由
能转化为
能,最终转化为机械能;
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为 ,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由
能转化为
能,最终转化为机械能;
 (2)通过车用燃油的精炼加工处理,可减少汽车尾气中的
(填化学式,多填本空不得分)排放;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的
(填化学式,多填本空不得分)排放;
 (3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式
。
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式
。
答案(1)4CmHn +(4m+n)O2  2nH2O
+ 4mCO2 ;化学;热能
2nH2O
+ 4mCO2 ;化学;热能
(2)SO2 (3)2NOx+ 2xCO  N2 + 2x CO2
N2 + 2x CO2
[解析](1)汽油燃烧的化学方程式为:
4CmHn
+(4m+n)O2  2nH2O
+ 4mCO2 ,燃烧过程为化学能转化为热能。
2nH2O
+ 4mCO2 ,燃烧过程为化学能转化为热能。
(2)精炼汽油可以减少其中硫的含量从而减少二氧化硫的排放大。
(3)这和(1)一样,也是属于对未知物反应方程式的配平:2NOx+ 2xCO  N2 + 2x CO2
N2 + 2x CO2
13. (9分)
(9分)
 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。





 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
 (3)写出另外一种实验室制取H的化学方程式
(3)写出另外一种实验室制取H的化学方程式
 (4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
答案(1)反应①的方程式:4HCl(浓) + MnO2  MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
(2)反应②的离子方程式:6I-+ ClO3- + 6H+ = 3I2+Cl- + 3H2O
(3)2H2O2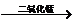 2H2O + O2↑(也可用高锰酸钾加热分解)
2H2O + O2↑(也可用高锰酸钾加热分解)
(4)D溶液与Pb(NO3)2
反应生成沉淀为PbI2 ,PbI2 Pb2+ +
2I-
Pb2+ +
2I-
Ksp= c(Pb2+)·c(I-)2 = c(Pb(NO3)2 ) ÷2 ·(10-2÷2)2= 7.0×10-9
所以c(Pb(NO3)2 ) = 5.6×10-4 mol·L-1
[解析]首先得破框图,G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。
12.已知:Fe2O3(s)
+  C(s)
=
C(s)
=  CO2(g)
+ 2 Fe(s) ΔΗ=234.1 kJ·mol-1
CO2(g)
+ 2 Fe(s) ΔΗ=234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔΗ=-393.5 kJ·mol-1
则2 Fe(s)+  O2(g)
= Fe2O3(s) 的ΔΗ 是
O2(g)
= Fe2O3(s) 的ΔΗ 是
A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-169.4 kJ·mol-1
答案A
[解析] (2)=(1)就可得2 Fe(s)+
(2)=(1)就可得2 Fe(s)+  O2(g) = Fe2O3(s),则ΔΗ=
O2(g) = Fe2O3(s),则ΔΗ= ΔΗ2-ΔΗ1=-824.4 kJ·mol-1。
ΔΗ2-ΔΗ1=-824.4 kJ·mol-1。

 第Ⅱ卷
第Ⅱ卷
 本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第20题为选考题,考生根据要求做答。
本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第20题为选考题,考生根据要求做答。
11. 在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:
在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:


 A.+1 B.+2 C.+3 D.+4
A.+1 B.+2 C.+3 D.+4
答案C
[解析]设氯化物化学式为MClx
MClx -- x AgNO3
1 x
5mL×0.05 mol·L-1 0.1 mol·L-1×7.5mL
x = 3
10.
 门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
 A.X单质不易与水反应
B.XO2可被碳或氢还原为X
A.X单质不易与水反应
B.XO2可被碳或氢还原为X
 C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
答案D
[解析]根据元素周期律,同族元素随着原子序数的递增,非金属性减弱,气态氢化物的稳定性减弱。故D选项有明显错误。其他选项可由硅的性质进行类推。
9. 在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
 A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
 C.CO2、C12、CaO、SO3 D.SiO2、N2O5、CO、C12
C.CO2、C12、CaO、SO3 D.SiO2、N2O5、CO、C12
答案B
[解析]题中的关键词“过量NaOH溶液”,A中只能生成4种盐;B生成5种(NaCl、NaClO、NaAlO2、NaNO3、Na2SO4);C中CaO不能生成盐;D中CO不能成盐。
8. 下列叙述正确的是(用NA代表阿伏加德罗常数的值)
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
 A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
 B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
 C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
 D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
答案C
[解析]A中镁为0.1mol,失去的电子数为0.2 NA;B中盐酸无体积,不能计算出粒子数;D选项中使用气体摩尔体积不是在标准状况下。
7. 用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:
用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:
 A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
答案C
[解析]设此铅氧化物的化学式PbxOy ,
PbxOy-- y[O]-- yCO-- y CO2-- yCaCO3
16y 100y
m(O)=1.28g 8.0g
所以m(Pb) = 13.7g- 1.28g = 12.42g
x∶y =  ∶
∶ =3∶4
=3∶4
6. 已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
 A.该溶液的pH=4
A.该溶液的pH=4
 B.升高温度,溶液的pH增大
B.升高温度,溶液的pH增大
 C.此酸的电离平衡常数约为1×10-7
C.此酸的电离平衡常数约为1×10-7
 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
答案B
[解析]根据HA在水中的电离度可算出c(H+)=0.1× 0.1%mol·L-1=10-4 mol·L-1,所以pH=4;因HA在水中有电离平衡,升高温度促进平衡向电离的方向移动,所以c(H+)将增大,pH值会减小;C选项可由平衡常数表达式算出K= =1×10-7 ,所以C无错误。c(H+)=10-4 mol·L-1 ,所以c(H+,水电离)= 10-10 mol·L-1,前者是后才的106倍。
=1×10-7 ,所以C无错误。c(H+)=10-4 mol·L-1 ,所以c(H+,水电离)= 10-10 mol·L-1,前者是后才的106倍。
5. 下列化合物分子中的所有碳原子不可能处于同一平面的是:
下列化合物分子中的所有碳原子不可能处于同一平面的是:
 A.甲苯 B.硝基苯 C.2-甲基丙烯 D.2-甲基丙烷
A.甲苯 B.硝基苯 C.2-甲基丙烯 D.2-甲基丙烷
答案D
[解析]在有机分子结构中,与苯环、碳碳双键直接相连的碳原子是在官能团所在的平面。故只有2-甲基丙烷的碳原子不可能处于同一平面。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com