
24. (13分)
(13分)
 从铝土矿(主要成分是
从铝土矿(主要成分是 ,含
,含 、
、 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:


 请回答下列问题:
请回答下列问题:
 (1)流程甲加入盐酸后生成Al3+的方程式为_________.
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
 (2)流程乙加入烧碱后生成Si
(2)流程乙加入烧碱后生成Si 的离子方程式为________.
的离子方程式为________.
 (3)验证滤液B含
(3)验证滤液B含 ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。
 (4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
 (5)已知298K时,
(5)已知298K时, 的容度积常数
的容度积常数 =5.6×
=5.6× ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的 =_______.
=_______.
 [答案]
[答案]
 (1)Al2O3 + 6H+
(1)Al2O3 + 6H+  2Al3+ +3H2O
2Al3+ +3H2O
 (2)SiO2 + 2OH-
(2)SiO2 + 2OH-  SiO32 - + H2O
SiO32 - + H2O
 (3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
 (4)NaHCO3;制纯碱或做发酵粉等合理答案
(4)NaHCO3;制纯碱或做发酵粉等合理答案
 (5)5.6×10-10mol/L
(5)5.6×10-10mol/L
 [解析](1)与HCl反应生成Al3+,应为铝土矿中Al2O3。(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。(5)
[解析](1)与HCl反应生成Al3+,应为铝土矿中Al2O3。(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。(5) ,
, =5.6×10-12/(0.1)2=5.6×10-10。
=5.6×10-12/(0.1)2=5.6×10-10。
 [考点分析]化学实验、化学与技术、铝土矿中氧化铝提取的工艺流程综合考查
[考点分析]化学实验、化学与技术、铝土矿中氧化铝提取的工艺流程综合考查

23. (15分)
(15分)

 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
 (1)T的原子结构示意图为_______.
(1)T的原子结构示意图为_______.
 (2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
 (3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
 (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
 [答案]
[答案]
 (1)
(1) (2)弱于
(2)弱于
 (3)S + 2H2SO4(浓)
(3)S + 2H2SO4(浓)  3SO2↑+ 2H2O
3SO2↑+ 2H2O
 (4)2H2O2
MnO22H2O + O2↑(或其他合理答案)
(4)2H2O2
MnO22H2O + O2↑(或其他合理答案)
 (5)NaNO2
(5)NaNO2
 (6)(3a
– 4b)KJ/mol
(6)(3a
– 4b)KJ/mol
 [解析]结合题目信息,结合T在周期表的位置与族序数相等这一条件
,可以得出T为Al,Q为C,R为N,W为S。(1)T为Al,13号元素。(2)根据S、C最高价氧化物对应的酸性硫酸强于碳酸,则可得非金属性S强于C。(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。(5)N中相对分子质量最小的氧化物为NO,2NO
+ O2 = 2NO2,显然NO过量1L,同时生成1L的NO2,再用NaOH吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3N的化合物NaNO2。(6)C + O2
[解析]结合题目信息,结合T在周期表的位置与族序数相等这一条件
,可以得出T为Al,Q为C,R为N,W为S。(1)T为Al,13号元素。(2)根据S、C最高价氧化物对应的酸性硫酸强于碳酸,则可得非金属性S强于C。(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。(5)N中相对分子质量最小的氧化物为NO,2NO
+ O2 = 2NO2,显然NO过量1L,同时生成1L的NO2,再用NaOH吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3N的化合物NaNO2。(6)C + O2  CO2
△H= -a KJ/mol①,4Al +3 O2 =2Al2O3 △H= -4bKJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al + 3CO2
CO2
△H= -a KJ/mol①,4Al +3 O2 =2Al2O3 △H= -4bKJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al + 3CO2 3C + 2Al2O3,此反应的H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)KJ/mol.
3C + 2Al2O3,此反应的H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)KJ/mol.
 [考点分析] 无机物的性质、化学用语、化学方程式书写、氧化还原反应以及热化学有关计算
[考点分析] 无机物的性质、化学用语、化学方程式书写、氧化还原反应以及热化学有关计算

12. 某探究小组利用丙酮的溴代反应(
某探究小组利用丙酮的溴代反应( )来研究反应物浓度与反应速率的关系。反应速率
)来研究反应物浓度与反应速率的关系。反应速率 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:

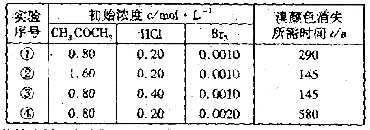
 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
 A. 增大
A. 增大 增大 B. 实验②和③的
增大 B. 实验②和③的 相等
相等
 C. 增大
C. 增大
 增大
D. 增大
增大
D. 增大 ,
, 增大
增大
 [答案]D
[答案]D
 [解析]从表中数据看,①④两组实验中CH3COCH3,HCl的浓度是相同的,而④中Br2比①中的大,所以时间变长,速率变慢,D错误。其他选项正确。
[解析]从表中数据看,①④两组实验中CH3COCH3,HCl的浓度是相同的,而④中Br2比①中的大,所以时间变长,速率变慢,D错误。其他选项正确。
 [考点分析]化学反应速率及其影响因素
[考点分析]化学反应速率及其影响因素

11.
 控制适合的条件,将反应
控制适合的条件,将反应 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
 A. 反应开始时,乙中石墨电极上发生氧化反应
A. 反应开始时,乙中石墨电极上发生氧化反应
 B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
 C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
 D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
 [答案]D
[答案]D
 [解析]乙中I-失去电子放电,发生氧化反应,A正确;由总反应方程式知,Fe3+被还原成Fe2+,B正确;当电流计为零时,说明没有电子发生转移,反应达到平衡,C正确。加入
[解析]乙中I-失去电子放电,发生氧化反应,A正确;由总反应方程式知,Fe3+被还原成Fe2+,B正确;当电流计为零时,说明没有电子发生转移,反应达到平衡,C正确。加入
 Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,D错误。
Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,D错误。

 [考点分析]原电池原理综合考查
[考点分析]原电池原理综合考查
10. 在一定条件下,Na2CO3溶液存在水解平衡:
在一定条件下,Na2CO3溶液存在水解平衡: 。下列说法正确的是
。下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
A. 稀释溶液,水解平衡常数增大
 B. 通入CO2,平衡朝正反应方向移动
B. 通入CO2,平衡朝正反应方向移动
 C. 升高温度,
C. 升高温度,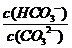 减小
减小
 D. 加入NaOH固体,溶液PH减小
D. 加入NaOH固体,溶液PH减小
 [答案]B
[答案]B
 [解析]平衡常数仅与温度有关,故稀释时平衡常数是不变的,A错误;CO2通入水中,生成H2CO3,可以与OH-反应,平衡正向移动,B正确;升温可以促进水解,平衡正向移动,
[解析]平衡常数仅与温度有关,故稀释时平衡常数是不变的,A错误;CO2通入水中,生成H2CO3,可以与OH-反应,平衡正向移动,B正确;升温可以促进水解,平衡正向移动,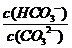 是增大的,C错误; 加入NaOH固体,碱性肯定增强,pH增大,D错误。
是增大的,C错误; 加入NaOH固体,碱性肯定增强,pH增大,D错误。

 [考点分析]平衡常数、PH、化学平衡及其移动
[考点分析]平衡常数、PH、化学平衡及其移动
9. 下列关于常见有机物的说法不正确的是
下列关于常见有机物的说法不正确的是
 A. 乙烯和苯都能与溴水反应
A. 乙烯和苯都能与溴水反应
 B. 乙酸和油脂都能与氢氧化钠溶液反应
B. 乙酸和油脂都能与氢氧化钠溶液反应
 C. 糖类和蛋白质都是人体重要的营养物质
C. 糖类和蛋白质都是人体重要的营养物质
 D. 乙烯和甲烷可用酸性高锰酸钾溶液鉴别
D. 乙烯和甲烷可用酸性高锰酸钾溶液鉴别
 [答案]A
[答案]A
 [解析]苯不能与溴水发生反应,只能与液溴反应,A错误;乙酸与NaOH发生酸碱中和,油脂在碱性条件能水解,B正确;糖类,油脂和蛋白质是重要营养的物质,C正确;乙烯可以使高锰酸钾褪色,而甲烷不可以,D正确。
[解析]苯不能与溴水发生反应,只能与液溴反应,A错误;乙酸与NaOH发生酸碱中和,油脂在碱性条件能水解,B正确;糖类,油脂和蛋白质是重要营养的物质,C正确;乙烯可以使高锰酸钾褪色,而甲烷不可以,D正确。
 [考点分析]有机化合物性质
[考点分析]有机化合物性质
8. 设NA为阿伏伽德罗常数,下列叙述正确的是
设NA为阿伏伽德罗常数,下列叙述正确的是
A. 24g镁的原子量最外层电子数为NA
B. 1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C. 1mol甲烷分子所含质子数为10NA
D. 标准状况下,22.4L乙醇的分子数为NA
[答案]C
[解析]镁的最外层电子数为2,A错误; 乙酸为弱电解质,部分电离,故H+小于0.1NA,B错误; CH4的质子数为10,C正确;乙醇标状是液体,D错误。
[考点分析]阿伏伽德罗常数正误判断
7. 能实现下列物质间直接转化的元素是

A. 硅 B. 硫 C. 铜 D. 铁
[答案]B
[解析]S与O2生成SO2,SO2再与H2O生成H2SO3,H2SO3可以与NaOH生成Na2SO3,B项正确。SiO2 、 CuO、Fe3O4均不与H2O反应,A、C、D错误。
[考点分析]元素化合物之间的转化关系
6. 下列类型的反应,一定发生电子转移的是
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
[答案]C
[解析]二氧化碳与水化合,碳酸氢铵分解,盐酸与氢氧化钠中和反应,这三个都是非氧化还原反应,没有发生电子转移。A、B、D错误。置换反应中肯定有单质参加,一定属于氧化还原反应,即一定有电子转移,C项正确。
[考点分析]基本反应类型和氧化还原反应的关系
29. (14分)苄佐卡因时一中医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原X经下列反应制得:
(14分)苄佐卡因时一中医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原X经下列反应制得:


 请回答下列问题:
请回答下列问题:
 (1)写出A、B、C的结构简式:A
、B
、C
。
(1)写出A、B、C的结构简式:A
、B
、C
。
 (2)用
(2)用 核磁共振谱可以证明化合物C中有
种氢气、处于不同的化学环境。
核磁共振谱可以证明化合物C中有
种氢气、处于不同的化学环境。
 (3)写出同时符合下列要求的化合物C的所有同分异构体的结构简式(E、F、G除外)
(3)写出同时符合下列要求的化合物C的所有同分异构体的结构简式(E、F、G除外)
 ①化合物是1,4-二取代苯,期中苯环上的一个取代基是硝基
①化合物是1,4-二取代苯,期中苯环上的一个取代基是硝基
 ②分子中含有
②分子中含有 结构的基因
结构的基因
 注:E、F、G结构如下:
注:E、F、G结构如下:


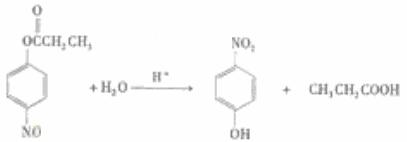
 (4)E、F、G中有一化合物经酸性水解,期中的一种产物能与FeCL3溶液发生显色反应,写出该水解反应的化学方程式
。
(4)E、F、G中有一化合物经酸性水解,期中的一种产物能与FeCL3溶液发生显色反应,写出该水解反应的化学方程式
。
 (5)苄佐卡因(D)的水解反应如下:
(5)苄佐卡因(D)的水解反应如下:

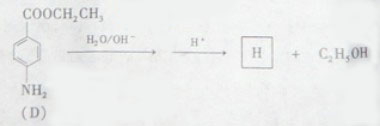
 化合物H经聚合反应可制成高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该聚合反应的化学方程式
。
化合物H经聚合反应可制成高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该聚合反应的化学方程式
。
 答案
答案
 (1)A:
(1)A:  B:CH3CH2OH C:
B:CH3CH2OH C: 
 (2)4
(2)4
 (3)
(3) 
 (4)
(4) 
 (5)
(5) 
 [解析](1)流程图非常简单,生成A,即为KMnO4氧化苯环上的甲基而生成羧基。A→C,结合D产物,显然为A与乙醇在浓硫酸作用下发生酯化反应。最后将硝基还原即等氨基。(2)从C的结构简式
[解析](1)流程图非常简单,生成A,即为KMnO4氧化苯环上的甲基而生成羧基。A→C,结合D产物,显然为A与乙醇在浓硫酸作用下发生酯化反应。最后将硝基还原即等氨基。(2)从C的结构简式 看,硝基邻、对位上的H,亚甲基和甲基上的H,共四种不同的氢谱。(3)满足要求的同分异构体必须有:取代在苯环的对位上,且含有酯基或羧基的结构。从已经给出的同分异体看,还可以写出甲酸形成的酯,以及羧酸。(4)能与FeCl3发生显色反应的必须是酚,显然F可以水解生成酚羟基。(5)D物质水解可生成对氨苯甲酸,含有氨基和羧基两种官能团,它们可以相互缩聚形成聚合物。
看,硝基邻、对位上的H,亚甲基和甲基上的H,共四种不同的氢谱。(3)满足要求的同分异构体必须有:取代在苯环的对位上,且含有酯基或羧基的结构。从已经给出的同分异体看,还可以写出甲酸形成的酯,以及羧酸。(4)能与FeCl3发生显色反应的必须是酚,显然F可以水解生成酚羟基。(5)D物质水解可生成对氨苯甲酸,含有氨基和羧基两种官能团,它们可以相互缩聚形成聚合物。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com