
12.下列热化学方程式数学正确的是(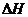 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热)
D. 2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
答案C
[解析]A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,A项错误;中和反应是放热反应,△H应小于0,B项错误;热化学反应方程式要注明物质在反应时的状态,D项错误;答案C正确。
[考点分析]本题考查燃烧热以及热化学方程式的书写正误判断。
11.下列对有机物结构或性质的描述,错误的是
A.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
B.苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚弱
C.乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O
D.光照下2,2-二甲基丙烷与Br2反应其一溴取代物只有一种
答案B
[解析]B项CO2
+ H2O + C6H5ONa C6H5OH + NaHCO3,则碳酸的酸性比苯酚强,B错误。
C6H5OH + NaHCO3,则碳酸的酸性比苯酚强,B错误。
[考点分析]本题考查化学反应、化学反应方程式、同分异构、物质的量等。
10.物质的量浓度相同的下列溶液,pH由大到小排列正确的是
A.Ba(OH)2、 Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2SO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
答案B
[解析]A项FeCl3是强酸弱碱盐溶液呈酸性,KCl是强碱强酸盐溶液呈中性,A错误;C项H3PO4显酸性,C错误;D项C2H5OH呈中性,C6H5COOH呈酸性,D错误;答案选B。
[考点分析]本题考查溶液的酸碱性。
9.下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价
答案C
[解析]A项SO2具有还原性和氧化性,在作漂白剂时并不发生氧化还原反应,而是与品红中的有色物质发生化合而褪色;B项Na是活泼金属,Na与MgCl2溶液反应时,先与水反应得到H2,D项Fe与其它非金属反应的产物的化合价取决于非金属的氧化性强弱,并不一定是+3价,如Fe与S反应生成FeS中Fe显+2价,D错误;答案选C。
[考点分析]本题考查化学反应及其物质的性质。
8.下列各组离子,能在溶液中大量共存的是
A.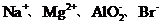 B
B 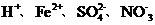
C. D
D 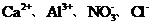
答案D
[解析]A项Mg2+水解呈酸性,AlO2-水解呈碱性,Mg2+与AlO2-发生双水解,Mg2++2AlO2-+4H2O====2Al(OH)3↓+Mg(OH)2↓不能大量共存;A项错误;B项在酸性条件下NO3-具有强氧化性,Fe2+与NO3-不能大量共存B项错误;C项NH4+与OH-结合成弱电解质NH3·H2O不能大量共存,C项错误;答案选D。
[考点分析]本题考查离子的大量共存。
7.有关实验的叙述,正确的是
A.将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH是指上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
答案D
[解析]A项容量瓶不能用来直接盛装固体配置溶液,要将固体先在烧杯中溶解,冷却至室温转移到容量瓶中,A项错误;B项pH不能润湿,润湿后会改变待测夜的浓度,从而测定不准,B项错误;C项进行焰色反应时铂丝用浓盐酸洗涤并灼烧,如用NaOH洗涤会使NaOH粘附在铂丝上,干扰检验其它金属元素的焰色反应,C项错误;D项正确。
[考点分析]本题考查化学基本实验操作、仪器使用等。
6.材料与化学密切相关,表中对应系错误的是
|
|
材料 |
主要化学成分 |
|
A |
刚玉、金刚石 |
三氧化二铝 |
|
B |
大理石、石灰石 |
碳酸钙 |
|
C |
普通水泥、普通玻璃 |
硅酸盐 |
|
D |
沙子、石英 |
二氧化硅 |
答案A
[解析]金刚石是由碳元素组成的单质,而不是三氧化铝,A项错误。
[考点分析]本题考查考生对物质组成成分的认识。
31. [化学--有机化学基础](13分)
[化学--有机化学基础](13分)
 有机物A是最常用的食用油氧化剂,分子式为C10H12O5,可发生如下转化:
有机物A是最常用的食用油氧化剂,分子式为C10H12O5,可发生如下转化:

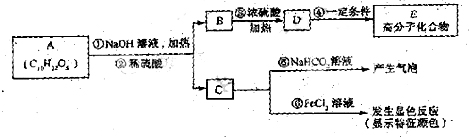



 已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:

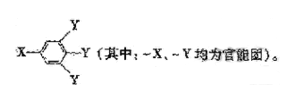
 请回答下列问题:
请回答下列问题:
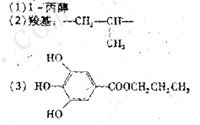
 (1)根据系统命名法,B的名称为
。
(1)根据系统命名法,B的名称为
。
 (2)官能团-X的名称为
,高聚物E的链节为
。
(2)官能团-X的名称为
,高聚物E的链节为
。
 (3)A的结构简式为
。
(3)A的结构简式为
。
 (4)反应⑤的化学方程式为
。
(4)反应⑤的化学方程式为
。
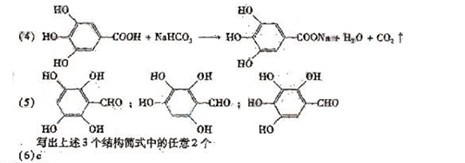
 (5)C有多种同分异构体,写出期中2种符合下列要求的同分异构体的结构简式
。
(5)C有多种同分异构体,写出期中2种符合下列要求的同分异构体的结构简式
。
 i.含有苯环
ii.能发生银镜反应 iii.不能发生水解反应
i.含有苯环
ii.能发生银镜反应 iii.不能发生水解反应
 (6)从分子结构上看,A具有抗氧化作用的主要原因是
(填序号)。
(6)从分子结构上看,A具有抗氧化作用的主要原因是
(填序号)。
 a.含有苯环
b.含有羰基
c.含有酚羟基
a.含有苯环
b.含有羰基
c.含有酚羟基
 [答案]
[答案]


 [解析]从框图中的信息知,C中含有羧基及酚基和苯环,又C的结构中有三个Y官能团,显然为羟基,若为羧基,则A的氧原子将超过5个。由此可得出C的结构为
[解析]从框图中的信息知,C中含有羧基及酚基和苯环,又C的结构中有三个Y官能团,显然为羟基,若为羧基,则A的氧原子将超过5个。由此可得出C的结构为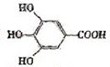 。A显然为酯,水解时生成了醇B和酸C。B中只有一个甲基,相对分子质量为60,60-15-17=28,则为两上亚甲基,所以B的结构式为CH3CH2CH2OH,即1-丙醇。它在浓硫酸作用下,发生消去反应,可生成CH3CH=CH2,双键打开则形成聚合物,其键节为
。A显然为酯,水解时生成了醇B和酸C。B中只有一个甲基,相对分子质量为60,60-15-17=28,则为两上亚甲基,所以B的结构式为CH3CH2CH2OH,即1-丙醇。它在浓硫酸作用下,发生消去反应,可生成CH3CH=CH2,双键打开则形成聚合物,其键节为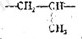 。由B与C的结构,不难写出酯A的结构简式为:
。由B与C的结构,不难写出酯A的结构简式为: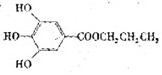 。C与NaHCO3反应时,只是羧基参与反应,由于酚羟基的酸性弱,不可能使NaHCO3放出CO2气体。(5)C的同分异构体中,能发生银镜反应,则一定要有醛基,不能发生水解,则不能是甲酸形成的酯类。显然,可以将羧基换成醛基和羟基在苯环作位置变换即可。(6)抗氧化即为有还原性基团的存在,而酚羟基易被O2氧化,所以选C项。
。C与NaHCO3反应时,只是羧基参与反应,由于酚羟基的酸性弱,不可能使NaHCO3放出CO2气体。(5)C的同分异构体中,能发生银镜反应,则一定要有醛基,不能发生水解,则不能是甲酸形成的酯类。显然,可以将羧基换成醛基和羟基在苯环作位置变换即可。(6)抗氧化即为有还原性基团的存在,而酚羟基易被O2氧化,所以选C项。

 [考点分析]有机物的推断及性质、注意官能团、同分异构体、反应类型综合考查
[考点分析]有机物的推断及性质、注意官能团、同分异构体、反应类型综合考查





30. [化学--物质结构与性质](13分)
[化学--物质结构与性质](13分)
 Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
 ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素;
 ②Y原子价电子(外围电子)排布msnmpn
②Y原子价电子(外围电子)排布msnmpn
 ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数;
 ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。
 请回答下列问题:
请回答下列问题:
 (1)Z2+ 的核外电子排布式是
。
(1)Z2+ 的核外电子排布式是
。
 (2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的
形成配位键。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的
形成配位键。
 (3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
 a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲>乙
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲>乙
 c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
 (4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(用元素符号作答)
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(用元素符号作答)
 (5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
。
 (6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
。
 [答案]
[答案]

 (1)1s22s22p63s23p63d9
(2)孤对电子(孤电子对)
(1)1s22s22p63s23p63d9
(2)孤对电子(孤电子对)
 (3)b (4)Si < C <N (5) 3:2 (6)原子晶体
(3)b (4)Si < C <N (5) 3:2 (6)原子晶体
 [解析]29号为Cu。Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si。R的核外L层为数,则可能为Li、B、N或F。Q、X的p轨道为2和4,则C(或Si)和O(或S)。因为五种元素原子序数依次递增。所以可推出:Q为C,R为N,X为O,Y为Si。(1)Cu的价电子排布为3d104s1,失去两个电子,则为3d9。(2)Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu提供空轨道,而形成配位键。(3)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4。因为SiH4 的相对分子质量比CH4大,故分子间作用力大,沸点高。(4)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,而N由于具有半充满状态,故第一电离能比相邻元素大,所以N>C>Si。(5)C、H形成的相对分子质量的物质为C2H2,结构式为H-C≡C-H,单键是σ键,叁键中有两个是σ键一个π键,所以σ键与π键数之比为3:2。(6)电负性最大的非元素是O,最小的非金属元素是Si,两者构成的SiO2,属于原子晶体。
[解析]29号为Cu。Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si。R的核外L层为数,则可能为Li、B、N或F。Q、X的p轨道为2和4,则C(或Si)和O(或S)。因为五种元素原子序数依次递增。所以可推出:Q为C,R为N,X为O,Y为Si。(1)Cu的价电子排布为3d104s1,失去两个电子,则为3d9。(2)Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu提供空轨道,而形成配位键。(3)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4。因为SiH4 的相对分子质量比CH4大,故分子间作用力大,沸点高。(4)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,而N由于具有半充满状态,故第一电离能比相邻元素大,所以N>C>Si。(5)C、H形成的相对分子质量的物质为C2H2,结构式为H-C≡C-H,单键是σ键,叁键中有两个是σ键一个π键,所以σ键与π键数之比为3:2。(6)电负性最大的非元素是O,最小的非金属元素是Si,两者构成的SiO2,属于原子晶体。
 [考点分析] 物质结构与性质综合运用
[考点分析] 物质结构与性质综合运用
25. (17分)
(17分)
 某研究性小组借助A-D的仪器装置完成有关实验
某研究性小组借助A-D的仪器装置完成有关实验

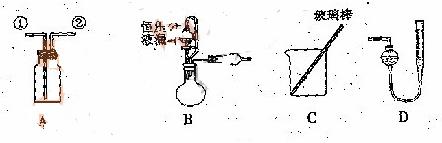
 [实验一]收集NO气体。
[实验一]收集NO气体。
(1)
 用装置A收集NO气体,正确的操作上 (填序号)。
用装置A收集NO气体,正确的操作上 (填序号)。
 a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气
d..从②口进气,用排气法集气
c.从②口进气,用排水法集气
d..从②口进气,用排气法集气
 [实验二]为了探究镀锌薄铁板上的锌的质量分数
[实验二]为了探究镀锌薄铁板上的锌的质量分数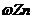 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
 (2)选用B和
(填仪器标号)两个装置进行实验。
(2)选用B和
(填仪器标号)两个装置进行实验。
 (3)测得充分反应后生成氢气的体积为VL(标准状况),
(3)测得充分反应后生成氢气的体积为VL(标准状况),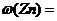 = 。
= 。
 (4)计算镀层厚度,还需要检索的一个物理量是
。
(4)计算镀层厚度,还需要检索的一个物理量是
。
 (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g
。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g
。
 (6)
(6)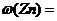 。
。
 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
 (7)从实验误差角度分析,方案丙
方案乙(填“优于”、“劣于”或“等同于”)。
(7)从实验误差角度分析,方案丙
方案乙(填“优于”、“劣于”或“等同于”)。
 [答案]
[答案]
 (1)C (2)D (3)
(1)C (2)D (3) 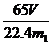 (或
(或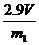 等其他合理答案)
等其他合理答案)
 (4)金属锌的密度(或其他合理答案)
(4)金属锌的密度(或其他合理答案)
 (5)偏大
(5)偏大
 (6)
(6)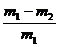 (或其他合理答案)
(或其他合理答案)
 (7)劣于
(7)劣于
 [解析](1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。排水时应用短进长出。(2)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。所以需要的装置有测H2的体积的D装置。(3)Zn与H2之间量为1:1,则n(Zn)=V/22.4
mol,w (Zn)=m(Zn)/m1
=
[解析](1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。排水时应用短进长出。(2)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。所以需要的装置有测H2的体积的D装置。(3)Zn与H2之间量为1:1,则n(Zn)=V/22.4
mol,w (Zn)=m(Zn)/m1
= 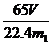 。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。(6)减少的质量即为Zn的质量。(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。(6)减少的质量即为Zn的质量。(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
 [考点分析]化学实验的探究、实验方案评价、气体的收集、化学计算综合考查
[考点分析]化学实验的探究、实验方案评价、气体的收集、化学计算综合考查




 选考部分
选考部分
 第II卷选考部分共5题,共35分。其中第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28题、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分,第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
第II卷选考部分共5题,共35分。其中第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28题、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分,第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com