
2.函数值域的求法:①分析法 ;②配方法 ;③判别式法 ;④利用函数单调性 ;⑤换元法 ;
⑥利用均值不等式 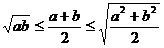 ; ⑦利用数形结合或几何意义(斜率、距离、
; ⑦利用数形结合或几何意义(斜率、距离、
绝对值的意义等);⑧利用函数有界性(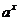 、
、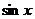 、
、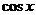 等);⑨平方法;⑩ 导数法
等);⑨平方法;⑩ 导数法
1.映射:注意: ①第一个集合中的元素必须有象;②一对一或多对一.
4.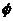 是任何集合的子集,是任何非空集合的真子集.
是任何集合的子集,是任何非空集合的真子集.
3.(1) 元素与集合的关系: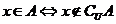 ,
,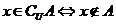 .
.
(2)德摩根公式: 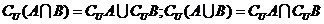 .
.
(3)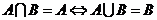
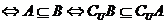

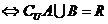
注意:讨论的时候不要遗忘了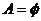 的情况.
的情况.
(4)集合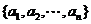 的子集个数共有
的子集个数共有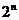 个;真子集有
个;真子集有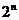 –1个;非空子集有
–1个;非空子集有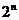 –1个;
–1个;
非空真子集有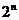 –2个.
–2个.
2.数形结合是解集合问题的常用方法:解题时要尽可能地借助数轴、直角坐标系或韦恩图等工具,将抽象的代数问题具体化、形象化、直观化,然后利用数形结合的思想方法解决
1.理解集合中元素的意义是解决集合问题的关键:元素是函数关系中自变量的取值?还是因变量的取值?还是曲线上的点?…
28. (16分)星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
(16分)星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
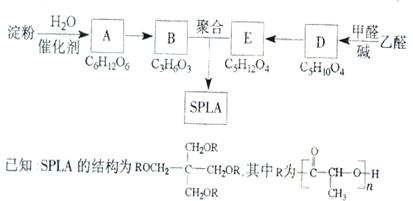
(1)淀粉是 糖(填“单”或“多”);A的名称是 。
(2)乙醛由不饱和烃制备的方法之一是 (用化学方程式表示,可多步)。
(3)D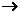 E的化学反应类型属于
反应;D结构中有3个相同的基团,且1molD能与2molAg(NH3)2OH反应,则D的结构简式是 ;D与银氨溶液反应的化学方程式为
。
E的化学反应类型属于
反应;D结构中有3个相同的基团,且1molD能与2molAg(NH3)2OH反应,则D的结构简式是 ;D与银氨溶液反应的化学方程式为
。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2反应,且1molG与足量Na反应生成1mol H2,则G的结构简式为 。
(5)B有多种脱水产物,其中两种产物的结构简式为 和 。
答案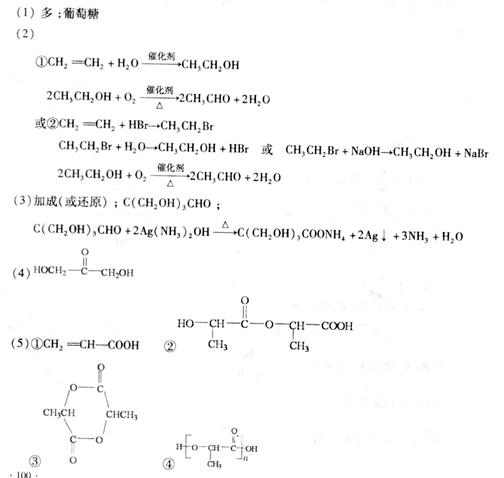
[解析](1)由框图可以知道淀粉水解成A,A是葡萄糖,A转化为乳酸B,根据所学知识知道淀粉是一种多糖。(2)乙醛的制备方法较多,可以用乙烯水化法转化为乙醇,乙醇氧化成乙醛,或用乙炔与水发生加成反应也可,此题方法较多。(3)由D、E的化学式可以看出E比D多2个H原子,加氢叫还原,加氢也是加成反应,1molD能与2molAg(NH3)2OH反应,说明1molD中有1mol-CHO,D结构中有3个相同的基团,经分析相同的3个基团为-(CH2OH),分子式C5H10O4就剩下一个-C,D的结构简式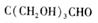 ,D与银氨溶液反应的化学方程式为:
,D与银氨溶液反应的化学方程式为: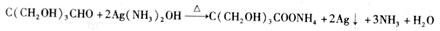 。
。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2反应,且1molG与足量Na反应生成1mol H2,G中无-COOH,无-CHO,1molG中有2mol-OH,即可得G的结构简式为: 。
。
(5)B是乳酸,由其官能团的反应机理即可得到答案。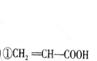 、
、 、
、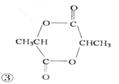 、
、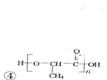 。
。
[考点分析]本题是考查有机物的综合推断、同分异构体的书写、有机化学反应类型、有机化学反应方程式的书写等知识。
29(15分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1) X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为
。
(2) X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
(3) 一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质地电子式为 ;Z分子的结构呈
②A的化学式是
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是
答案
 [解析](1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X为Al元素,X的原子结构示意图为
[解析](1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X为Al元素,X的原子结构示意图为
(2)铝盐与过量NaOH溶液反应转化为偏铝酸盐,发生的离子反应方程式为:
Al3++4OH-===AlO2-+2H2O。
(3)①A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子个电子,可以推测Z是一种氢化物,常见的氢化物由NH3、CH4、HF等;Z与H2O2反应,其产物之一是Y的单质,知道Z是NH3。②A具有良好的耐热冲击性能,由以上几种元素与Al构成的化合物来看只有N与Al构成AlN。(4)由题意可以得到答案。
[考点分析]本题考查元素及其化合物的综合推断。

27.(15分)两个学习小组用题27图装置探究乙二酸(HOOC-COOH)受热分解的部分产物。
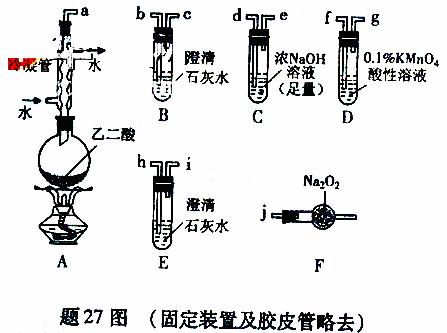
(1)甲组:
①按接口顺序:a-b-c-d-e-f-g-h连接装置进行实验。B中溶液变浑浊,证明分解产物有 ;装置C的作用是 ;E中溶液变浑浊,D中的现象是 ,证明分解产物有 。
②乙二酸受热分解的化学方程式为 。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为 。
②从A-F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。最简单的装置接口连接顺序是 ;实验后用F中的固体进行验证的方法是 (可另选试剂)。
答案
[解析](1)①B中澄清石灰水变浑浊,证明分解产物有CO2产生;装置C的作用是充分除去CO2,防止对后继实验产物检验的干扰;E中澄清石灰水变浑浊,说明有CO2产生,乙二酸产生的CO2在C装置中已经被NaOH吸收完全,CO2的产生来源于D装置中高锰酸钾对CO的氧化,D中现象为溶液褪色(或变浅),证明分解产物有CO。②乙二酸受热分解的化学方程式为:HOOC-COOH CO2↑+CO↑+H2O。(2)①接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,说明有氧气产生,通过冷凝管后出来主要是CO2,CO2与Na2O2反应的化学方程式为:2CO2+Na2O2===
2Na2CO3+O2。②先要制备气体,将产生的CO2吸收,再通入到Na2O2中证明。连接顺序为:a→d→e→j;要证明发生了反应,即证明F中的物质是Na2CO3,方法较多。
CO2↑+CO↑+H2O。(2)①接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,说明有氧气产生,通过冷凝管后出来主要是CO2,CO2与Na2O2反应的化学方程式为:2CO2+Na2O2===
2Na2CO3+O2。②先要制备气体,将产生的CO2吸收,再通入到Na2O2中证明。连接顺序为:a→d→e→j;要证明发生了反应,即证明F中的物质是Na2CO3,方法较多。
[考点分析]本题综合考查化学实验、实验现象、实验设计、化学反应等知识。
26.(14分)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。
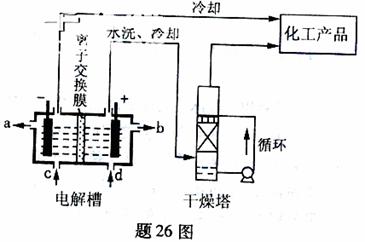
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为 。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
 (标准状况)。
(标准状况)。
答案(1)①氯气;a;d;浓硫酸(2)①SiCl4+2H2+O2 SiO2+4HCl②0.35(3)134.4
SiO2+4HCl②0.35(3)134.4
[解析](1)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-===Cl2↑;阴极:2H++2e-===H2↑;总反应为:2NaCl+2H2O Cl2↑+H2↑+2NaOH。H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,选d;要干燥Cl2需要用酸性干燥剂H2SO4或P2O5等,中性干燥剂无水CaCl2。(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可。发生的化学方程式为:SiCl4+2H2+O2
Cl2↑+H2↑+2NaOH。H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,选d;要干燥Cl2需要用酸性干燥剂H2SO4或P2O5等,中性干燥剂无水CaCl2。(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可。发生的化学方程式为:SiCl4+2H2+O2 SiO2+4HCl。②
SiO2+4HCl。②
 由3 SiCl4(g)+2H2(g)+Si(s)
由3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 3x 2x x 4x
平衡量(mol) n-2x 4x
4x=0.020mol/L×20L=0.4mol,n-2x=0.140mol/L20L=2.8mol,n=3.0mol,由2NaCl+2H2O Cl2↑+H2↑+2NaOH,(2×58.5)g:1mol=m(NaCl)g:3mol;m(NaCl)=351g=0.351kg。
Cl2↑+H2↑+2NaOH,(2×58.5)g:1mol=m(NaCl)g:3mol;m(NaCl)=351g=0.351kg。
(3)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,设产生的H2体积为V,由得失电子守恒有:6×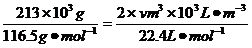 ;V=134.4m3。
;V=134.4m3。
[考点分析]本题考查电解、氯碱工业、化学平衡的计算、化学方程式书写、化学计算等知识。
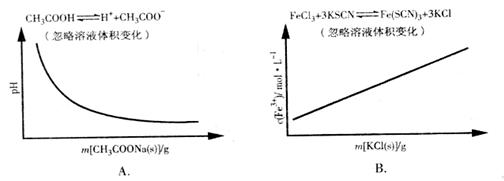
13.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
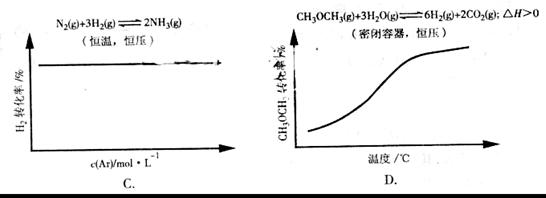
答案D
[解析]A项CH3COOH溶液中加入CH3COONa固体,CH3COOH溶液中CH3COO-浓度增加,电离平衡逆向移动,c(H+)减小,pH逐渐增大,A错误;B项加入KCl对平衡体系无影响,化学平衡不移动,B错误;C项恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度成倍减小(等效于减压),化学平衡朝体积增大方向移动,H2的改变量减小,起始量不变,转化率减小,C错误;大暗暗选D。
[考点分析]本题考查化学平衡的移动与化学平衡图像。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com