

27.(12分)有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为ns n np n+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D。
(1)上述元素中,E元素的原子结构示意图为 ;
D元素的外围电子排布式为 ;
(2)下列分子结构图中的 和
和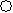 表示上述元素的原子中除去最外层电子的剩余部分, 小黑点表示没有形成共价键的最外层电子,短线表示共价键。
表示上述元素的原子中除去最外层电子的剩余部分, 小黑点表示没有形成共价键的最外层电子,短线表示共价键。
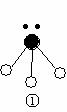
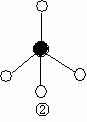
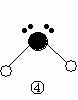
则在以上分子中,中心原子采用sp3杂化形成化学键的非极性分子是 (用化学式表示); 在③的分子中有 个σ键和 个π键。
(3)AgNO3 溶液与足量C的氢化物水溶液反应生成的配合物,其化学式为 ,该配合物中心原子通过 杂化方式与配位体以
键相结合。
26.(10分)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
⑴ 用元素名称表示: C
⑵ 用电子式表示离子化合物A2B的形成过程: 。
⑶ D元素形成的单质的结构式为: ;A、B、E形成的化合物的电子式为: 。
⑷ D、E形成的化合物分子的空间构型为: ,该物质为 (填“极性分子”或“非极性分子”)
(5) A、B、C、D四种元素的第一电离能由大到小的顺序为 (用元素符号表示)。
25. (6分)在下列物质中:①NaOH、②Na2S、③(NH4)2S、④Na2O2、⑤C2H2、
⑥金刚石、⑦SiO2晶体、⑧MgCl2、⑨干冰。
⑴只含有离子键的离子化合物是
;
⑵含离子键、极性键和配位键的化合物是
;
⑶含有非极性键的离子晶体是
;
⑷含有极性键和非极性键的非极性分子是
;
⑸熔化时需要破坏共价键的化合物是 。
24.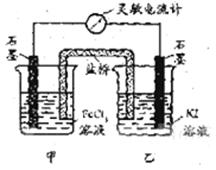 控制适合的条件,将反应
控制适合的条件,将反应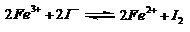 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
 A. 反应开始时,乙中石墨电极上发生氧化反应
A. 反应开始时,乙中石墨电极上发生氧化反应
 B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
 C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
 D. 电流计读数为零后,在甲中溶入FeCl2固体,
D. 电流计读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极

第II卷(共52分)
23. 经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的
排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情况是 
A.该溶液可能由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.该溶液可以由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度的关系符合c(CH3COO-)+c(OH-)>c(Na+)+c(H+)
D.在上述溶液中加入适量NaOH,离子浓度大小可改变为:
|

22. 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A、X与Y形成化合物是,X可以显负价,Y显正价
B、第一电离能可能Y小于X
C、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的酸性
D、气态氢化物的稳定性:HmY小于H nX
21. 在一密闭容器中,反应aA(g) bB(g)达到平衡后,保持温度不变,将容器
bB(g)达到平衡后,保持温度不变,将容器
体积增加1倍,达到新的平衡后,B的浓度是原来的40 % ,则

A.平衡向正反应方向移动 B.物质A的转化率变大
C.物质B的质量分数增加 D.a>b
20. 下列离子组中,能够在溶液中共存,加入NaOH溶液有沉淀生成,加入稀盐酸有
气体放出的是 
A.Na+、Fe2+、Cl-、SO42-
B.Ba2+、K+、CO32-、Cl-
C.Al3+、Ca2+、Cl-、NO D.Na+、Ba2+、NO
D.Na+、Ba2+、NO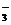 、HCO
、HCO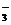

19. 用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,
且电解后溶液的pH增大的是

A.KCl B.NaOH 
C.Na2SO4 D.H2SO4
18. 室温时,下列混合溶液的pH一定小于7的是

A.pH=3的盐酸和pH=11的氨水等体积混合
B.0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com