
26.(10分)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
⑴ 用元素名称表示: C 
⑵ 用电子式表示离子化合物A2B的形成过程:
。
⑶ D元素形成的单质的结构式为:
;A、B、E形成的化合物的电子式为: 。
⑷ D、E形成的化合物分子的空间构型为: ,该物质为 (填“极性分子”或“非极性分子”)
(5) A、B、C、D四种元素的第一电离能由大到小的顺序为 (用元素符号表示)。
25. (6分)在下列物质中:①NaOH、②Na2S、③(NH4)2S、④Na2O2、⑤C2H2、
⑥金刚石、⑦SiO2晶体、⑧MgCl2、⑨干冰。
⑴只含有离子键的离子化合物是
;
⑵含离子键、极性键和配位键的化合物是
;
⑶含有非极性键的离子晶体是
;
⑷含有极性键和非极性键的非极性分子是
;
⑸熔化时需要破坏共价键的化合物是 。
24. 控制适合的条件,将反应
控制适合的条件,将反应 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
 A. 反应开始时,乙中石墨电极上发生氧化反应
A. 反应开始时,乙中石墨电极上发生氧化反应
 B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
 C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
 D. 电流计读数为零后,在甲中溶入FeCl2固体,
D. 电流计读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极

第II卷(共52分)
23. 经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的
排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情况是 
A.该溶液可能由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.该溶液可以由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度的关系符合c(CH3COO-)+c(OH-)>c(Na+)+c(H+)
D.在上述溶液中加入适量NaOH,离子浓度大小可改变为:
|

22. 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A、X与Y形成化合物是,X可以显负价,Y显正价
B、第一电离能可能Y小于X
C、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的酸性
D、气态氢化物的稳定性:HmY小于H nX
21. 反应2A(g)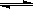 2B(g)+C(g);△H>0在一定条件下达到平衡后,要使A的转化率增大,可采取的措施是
A.加压
B.降低温度
C.增大A的浓度
D.升高温度
2B(g)+C(g);△H>0在一定条件下达到平衡后,要使A的转化率增大,可采取的措施是
A.加压
B.降低温度
C.增大A的浓度
D.升高温度
20. 下列离子组中,能够在溶液中共存,加入NaOH溶液有沉淀生成,加入稀盐酸有
气体放出的是 
A.Na+、Fe2+、Cl-、SO42-
B.Ba2+、K+、CO32-、Cl-
C.Al3+、Ca2+、Cl-、NO D.Na+、Ba2+、NO
D.Na+、Ba2+、NO 、HCO
、HCO

19. 用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,
且电解后溶液的pH增大的是

A.KCl B.NaOH 
C.Na2SO4 D.H2SO4
18. 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,若溶液仅含一种溶质,则这四种离子浓度的大小顺序是
A.c(NH4+)>c(Cl-)>c( OH-)>c(OH-)
B.c(NH4+)>c(Cl-)>c(H+)>c( OH-)
C.c(Cl-)>c(NH4+)>c(H+)>c( OH-)
D.c(Cl-)>c(NH4+)>c( OH-)>c( OH-)
17. l g炭与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为

A.C+H2O==CO+H2
△H=+131.3 kJ/mol
B.C(s)+H2O(g)==CO(g)+H2(g)
△H=+10.94 kJ/mol
C.C(s)+H2O(1)==CO(g)+H2(g) △H=+131.3 kJ/mol
D.C(s)+H2O(g)==CO(g)+H2(g) △H=+131.3 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com