
20. (10分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:
(10分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。
19.(12分)将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是__________,可能有的阳离子是________.(不考虑水电离出的H+,下同)
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是________,可能含有的阳离子是________.
(3)如果反应后的溶液中无金属剩余,则加入金属粉末的最大质量应小于________.
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属粉末的最小质量为________.
18.(10分)下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他为化合物.
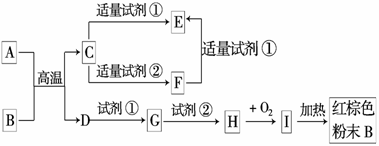
试推断:
(1)写出物质的化学式:A:____________.C:____________.I:____________.
(2)写出下列反应的方程式:
C→F的离子方程式______________________________________________.
H→I的化学方程式________________________________________________.
17.(10分)在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如下图所示。则:
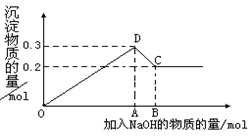
(1)写出代表各线段发生反应的离子方程式:
OD段 . _______,
DC段 __________________________ 。
(2)原溶液中Mg2+.Al3+物质的量浓度之比为 。
(3)图中C点表示当加入 mol NaOH时,Al3+已经转化为 ,Mg2+已经转化为 。
(4)图中线段OA∶AB= 。
16.(12分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
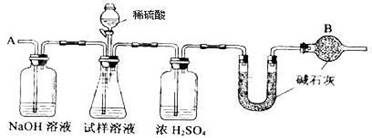
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 ;
(2)装置中干燥管B的作用是 ;
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高.偏低或不变);
(4)步骤⑤的目的是 ;
(5)步骤⑦的目的是 ;
(6)该试样中纯碱的质量分数计算式为 。
15.(12分)下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色的铁粉变为
黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请回答下列问题:

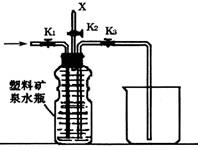
(1)B中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。
溶液颜色无明显变化,试解释原因 。
(4)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气体即可检验H2的存在。实验开始时,打开K1.K2,关闭K3,使反应先进行一段时间之后,必须进行 操作,方可关闭K2.打开K3,再收集气体。当收集到半瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法是 。
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是 。
14.向一定量的Fe.FeO.Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S.T.P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为 ( )
A. 68.6% B. 77.8% C. 81.4% D. 无法计算
第Ⅱ卷(非选择题 共78分)
13.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
|
|
Na |
Cu |
Al |
Fe |
|
熔点(0C) |
97.5 |
1083 |
660 |
1535 |
|
沸点(0C) |
883 |
2595 |
2200 |
3000 |
其中不能形成合金的是 ( )
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
12.混合下列各组物质使之充分反应,加热蒸干产物并在300 ℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.向CuSO4溶液中加入适量铁
B.等物质的量浓度.等体积的(NH4)2SO4与BaCl2溶液
C.等物质的量的NaHCO3与Na2O2固体
D.在NaBr溶液中通入过量氯气
11.在我国近年来报道的高温超导体中,铊(Tl)是组成成分之一。已知铊和铝是同族元素,关于铊的性质的推断可能错误的是 ( )
A.是银白色的软质金属
B. 能生成+3价的离子化合物
C.与硝酸作用能放出氢气并生成硝酸盐
D.铊的密度小于铝
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com