
4.溶液酸碱性判定规律
(1)pH相同的酸(或碱),酸(或碱)性越弱,其物质的量浓度越大。
(2)pH相同的强酸和弱酸溶液,加水稀释相同的倍数,则强酸溶液pH变化大;碱也如此。
(3)酸与碱的pH之和为14,等体积混合
①若为强酸与强碱 则pH=7
②若为强酸与弱碱 则pH>7
③若为弱酸与强碱 则pH<7
(4)等体积强酸(pH1)和强碱(pH2)混合
①若二者pH之和为14,则溶液呈中性,pH=7
②若二者pH之和大于14,则溶液呈碱性。
③若二者pH之和小于14,则溶液呈酸性。
3.水的电离和溶液的pH
(1)水是一种极弱的电解质:H2O+H2O H3O++OH-
H3O++OH-
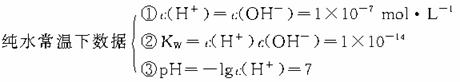
(2)影响水电离平衡的因素
①酸、碱
在纯水中加入酸或碱,均使水的电离平衡左移,此时若温度不变,KW不变;c(H+)发生改变,pH也随之改变;若向水中加入酸,则c(H+)增大,c(OH-)变小,pH变小。
②温度
若升温,由于水电离吸热,升温将促进水的电离,故平衡右移,c(H+)、c(OH-)同时增大,pH变小,但由于c(H+)与c(OH-)始终保持相等,故仍显中性。
③易水解的盐
在纯水中加入能水解的盐,不管水解后溶液显什么性,均促进水的电离,使水的电离程度增大,但只要温度不变,KW不变。
2.判断强弱电解质的方法规律
(1)0.01 mol·L-1酸HA溶液的pH≠2,说明酸HA在水溶液中没有完全电离,HA是弱酸。
(2)同pH的强酸、弱酸分别加入水稀释相同倍数,溶液的pH变化小的是弱酸,变化大的是强酸。
(3)同pH的强酸和弱酸,分别加该酸的钠盐,溶液的pH增大的是弱酸,pH几乎不变的是强酸。
(4)pH相同、体积相同的强酸和弱酸与碱反应时消耗多的为弱酸;与Zn或Na2CO3固体反应产生气体多的是弱酸。其他方法不再一一例举。
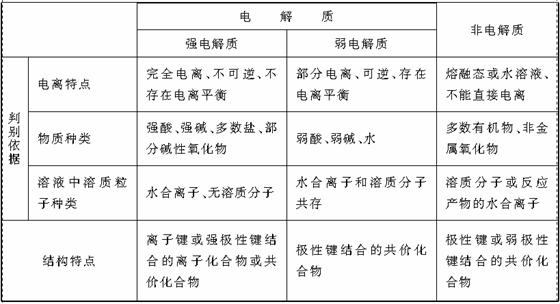
1.电解质与非电解质、强电解质与弱电解质的判别规律
35.答案:pH酸+pH碱=15
解析:由强酸强碱溶液的pH可知c(H+)酸或c(OH-)碱,两溶液混合后溶液呈中性,说明反应中n(H+)酸=n(OH-)碱。设该强酸溶液体积为10 L,强碱溶液体积为1升,则10c(H+)酸=c(OH-)碱,所以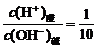 ,设强酸溶液中c(H+)酸=0.1
mol·L-1,c(OH-)碱=1 mol·
,设强酸溶液中c(H+)酸=0.1
mol·L-1,c(OH-)碱=1 mol·
L-1,则pH酸=1,pH碱=14,pH酸+pH碱=15。
●命题趋向与应试策略
34.答案:(1)A D (2)C D (3)D A
解析:反应后的C溶液为:0.01 mol·L-1 H2A、0.01 mol·L-1 NaHA和0.01 mol·
L-1 NaCl的混合液。因HA-的存在抑制了H2A的第一步电离,所以c(H+)小于A溶液中
c(H+),但c(H2A)大于A溶液c(H2A)。反应后D溶液为0.01 mol·L-1的Na2A溶液,所以
c(A2-)最大,但因其水解,c(H+)最小。
33.答案:(1)否 若a=3,则b=6,溶液显酸性,与题意不符,故a≠3 (2)否 若a=5,[H+]a=10-5 mol·L-1,则b=10,[OH-]b=10-4 mol·L-1,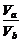 =
=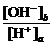 >1不符合题意,故a≠5 (3)
>1不符合题意,故a≠5 (3) <a<
<a<
解析:(1)若a=3,由a=0.5b可知b=6,由题设pH=b的是一元强碱,与题设矛盾,所以应答“否”。
(2)若a=5则b=10,[OH-]b=10-4 mol·L-1,中和时,应该有Va[H+]a=Vb[OH-]b
即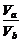 =
=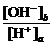 =
=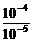 =10>1,与题设Va<Vb不符,所以也应答“否”。
=10>1,与题设Va<Vb不符,所以也应答“否”。
(3)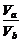 <1可得式
<1可得式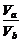 =
=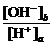 =
=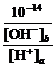 =
= =10a+b-14<1,又a=0.5b或(a+b-14)<0,1.5b<14,3a<14,a<
=10a+b-14<1,又a=0.5b或(a+b-14)<0,1.5b<14,3a<14,a< ,又pH?b=b=2a>7[由(1)小题提示强碱溶液的条件],
,又pH?b=b=2a>7[由(1)小题提示强碱溶液的条件],
a> ,因此a的取值范围是
,因此a的取值范围是 <a<
<a< 或(4.67>a>3.50)
或(4.67>a>3.50)
32.答案:BD
解析:A.加NaOH固体能减缓反应速率,但要消耗H+,减少氢气总量。C.NH4Cl固体不与盐酸反应,又不影响溶液的体积。在强酸性条件下不考虑其中水解。B.水既不影响溶液中H+的物质的量,又能稀释盐酸。D.CH3COONa能与盐酸生成弱电解质CH3COOH减缓反应速率,但不能影响H2总量。
31.答案:D
解析:物质中的“自由电子”和“自由移动的离子”是物质导电的必要条件,选项中只有固态氯化钾不含“自由移动的离子”。
30.答案:C
解析:由电离平衡看出,若使指示剂显红色必使平衡左移,而使平衡左移的条件是向溶液中加入H+。在给出的试剂中只有(1)、(4)溶于水电离出H+,故C选项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com