
2.(广东化学卷第11题 4分).元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高 D.同周期元素中Y的最高价含氧酸的酸性最强
1.答案:D
详解:IVA元素有碳、硅、锗、锡、铅;第四周期元素是锗,其化学性质类硅,硅不和水反应,锗也不和水反应,A不符合题意;二氧化硅可以被碳或氢还原为硅,二氧化锗也可以,B不符合题意;GeCl4和SiCl4都是分子晶体,分子间不能形成氢键,对于组成和结构相似的分子晶体,相对分子质量越大,沸点越高,C不符合题意;同主族元素,原子序数越小非金属性越强,非金属性越强,其最低价氢化物的稳定性越强,氢化物稳定性:SiH4>GeH4 ,D符合题意。
要点1:组成和结构相似的分子晶体(不含氢键),相对分子质量越大,沸点越高。
①.IVA最低价非金属氢化物的沸点由高到底顺序:GeH4>SiH4>CH4
②.IVA最高价氯化物的沸点由高到底顺序:GeCl4>SiCl4>CCl4
要点2:非金属性越强,其对应的最低价非金属氢化物越稳定。
①.同周期非金属元素原子序数越大非金属性越强,非金属性越强对应的最低价氢化物的稳定性越强:HF>H2O>NH3>CH4 ;HCl>H2S>PH3>SiH4 。
②.同主族非金属元素原子序数越小非金属性越强,非金属性越强对应的最低价氢化物的稳定性越强:HF>HCl>HBr>HI ;H2O>H2S>H2Se>H2Te ;NH3>PH3>AsH3 ;CH4>SiH4>GeH4 。
1.(海南化学卷第10题 3分)门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
31.(16分)
Ⅰ.①直接观察老叶和新叶黄化的先后顺序,若老叶先黄化,则缺镁;若新叶先黄化,则缺铁
②在A、B组叶片都出现了黄化现象后,添加镁或铁,观察叶片恢复正常的情况
Ⅱ.(1)水量在实验前后的液面
(2)①剪去部分叶片剪去全部叶片(次序可变换)
②对照(保留全部叶片)③相同温度、光照适宜
(3)叶片最多的装置水分减少明显
叶面积越大、气孔越多,蒸腾水分越多
[解析]Ⅰ.本题考查水培法和矿质元素的代谢特点,中等题。由于Mg属于可被再利用的矿质元素,而Fe属于不可转移的矿质元素,所以通过老叶和幼叶变黄的先后顺序可以判断缺素症是何种元素引起的;或者通过向培养液中添加Mg,Fe,然后观察症状是否恢复症状来判断缺素症是何种元素引起的。
Ⅱ. 本题考查试验设计,较易题。一般来说植物叶片越多,气孔就越多,在相同的温度条件下,通过蒸腾作用散失的水分就多,散失水分多少可以通过烧杯内的液面的变化来直接观察。
综评:
物理部分:本试卷考查了力、热、电、光、原子物理的基础知识点,覆盖面广,题型灵活,侧重于中、低档题的考查,较好地检测了二轮复习的效果。基础知识的考查,如14,15,16题;对知识的灵活应用,18题;对所学知识的规律总结,21题;对较复杂的运动过程的分析,24题;学科内的综合,25题。
化学部分:本套试卷考查内容全面,难度适宜,综合性较强,适合于二轮复习检测。选择题部分涉及的内容广,考点多,能够综合考查化学基础知识和基本技能。
生物部分:本试题生物部分难度适中,知识点覆盖面全,重点突出,较好地考查了学生的实验设计和分析能力。
(梁春莉 王波 张从民)
30.Ⅰ.(14分)
(1)(曲线)B减数(分裂的)第二次分裂受精作用
(2)0-48-13611
(3)画图要求:中心体、纺锤体、同源染色体形态及姐妹染色单体、细胞质不均等分裂等要符合要求。初级卵母细胞
(4)23个92条多于92条
(5)24种 (6)B (7)2
Ⅱ.(12分)
(1)常 显 (2)X隐aaXbY (3)1/8
[解析]Ⅰ.本题考查细胞的增殖,中等题。据图,曲线A中数量的加倍是一个渐变的过程,曲线B的加倍是一个突变过程,所以A表示DNA,B表示染色体,整个过程开始是减数分裂,之后是受精作用,然后是受精卵的有丝分裂;有丝分裂和减数第一次分裂过程中都含有同源染色体,着丝点分裂发生在有丝分裂后期和减数第二次分裂后期;绘图题要注意区分同源染色体和染色体的形态,行为和数目;来自同一个精原细胞的精子特点是两两相同,同源染色体互补。
Ⅱ. 本题考查遗传系谱图分析,中等题。(1)根据Ⅰ1、Ⅰ2和Ⅱ3,有中生无,而且无病是一个女孩,可以判断为常显;(2)根据Ⅱ1、Ⅱ2和Ⅲ2,无中生有,所以乙病一定是隐性遗传病,Ⅱ1不是携带者排除常染色体遗传;(3)因为Ⅲ1和Ⅲ5都不患甲病,后代也不可能患甲病,所以子女只有可能患乙病,Ⅲ1(1/2XBXb或者1/2XBXB)和Ⅲ5 XBY,所以生一个患一种病孩子的概率为1/2×1/4=1/8。
29.(17分)
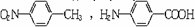 (1)③ ② ① (各1分,共3分)
(1)③ ② ① (各1分,共3分)
(2) 
 (各2分,共4分)
(各2分,共4分)
(3)不能 先把-NO2还原成-NH2,再氧化-CH3时,-NH2也易被氧化 (各2分,共4分)
 (4)
(4) 
 (3分)
(3分)
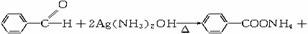

 3NH3+2Ag↓+H2O (3分)
3NH3+2Ag↓+H2O (3分)
[解析]本题考查有机合成和推断,中等题。根据信息Ⅰ和Ⅲ,制备(C7H5NO)n的流程为
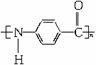

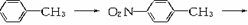







 Ⅱ,D为
Ⅱ,D为
 ,E为
,E为
 ,F为
,F为 。
。
28. (17分)
(1)F(或G)(1分) F中长导管水面上升,停止加热后水面下降(若填G,A加热后,G中导管口有气泡冒出……)(2分)
(2)反应中生成CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续。 (2分)
(3)除去气体中HCl 干燥气体 吸收装置D中反应剩余CO2 (各1分,共3分)
(4)2Na2O2+2CO2 ====2Na2CO3+O2 Na2O+CO2 ====Na2CO3 (各3分,共6分)
(5)78% (3分)
[解析]本题考查定量实验,中等题。实验原理是通过测定CO2与Na2O2反应产生氧气的体积,计算出混合物中Na2O2的质量。而制取CO2,利用的是CaCO3和盐酸的反应,由于盐酸具有挥发性,因此制取的CO2中必然含有HCl,可以通过饱和NaHCO3溶液除去。装置C为干燥CO2,装置E为除去O2中含有的CO2。根据2CO2+2Na2O2====2Na2CO3+O2,则混合物中Na2O2的质量为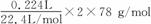 =1.56 g,因此Na2O2的质量分数为
=1.56 g,因此Na2O2的质量分数为 。
。
27.(14分)
(1)NH4HC2O4 (2分) 草酸氢铵 (2分)
(2)三角锥形 Na+[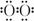 ]2-Na+ (各2分,共4分)
]2-Na+ (各2分,共4分)
(3)4NH3+3O22N2+6H2O(3分) (不写反应条件不得分)
(4)NH+HCO+2OH-NH3↑+CO+2H2O (3分)
[解析]本题考查无机推断,中等题。根据C为无色液体,G为淡黄色粉末状固体,则C为H2O,G为Na2O2,因此F为O2,从而可以推断D为CO2,E为CO。由于E与H的相对分子质量相等,则H为N2,故B为NH3。(1)根据质量守恒定律,可以推断A为草酸氢铵。(2)NH3为三角锥型分子,Na2O2的电子式为Na+[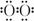 ]2-Na+。(3)反应②为NH3和O2反应生成H2O和N2。(4)物质K为NH4HCO3,与过量NaOH的反应为NH+HCO+2OH-====CO+NH3↑+2H2O
]2-Na+。(3)反应②为NH3和O2反应生成H2O和N2。(4)物质K为NH4HCO3,与过量NaOH的反应为NH+HCO+2OH-====CO+NH3↑+2H2O
26.(12分)每空2分
(1)碳 第二周期Ⅵ A族 (2)O2->Na+>Al3+
(3)H2O 液态水中存在氢键 (4)Al(OH)3+OH-===AlO+2HO
[解析]本题考查元素推断,中等题。(1)根据①,A为H,B为C;根据②,可以推断两种化合物为H2O、H2O2,因此C为O;根据③,可以推断D为Na;根据④,可以判断E的氢氧化物能与NaOH反应,因此E为Al。(2)根据相同电子层结构的粒子,核电荷数越大,粒子半径越小进行判断。(3)H2O分子间存在氢键,其沸点比CH4高。(4)反应④为NaOH和Al(OH)3的反应。
25.(22分)
解:(1)设小车的加速度为a1,对小车由牛顿第二定律
F-μmg=Ma1 解得:a1=16 m/s2 (3分)
小车进入磁场前有:L=a1t2 解得:t==0.5 s (3分)
(2)设F作用时间为t0,对物体B:a2=μg=4 m/s2
物体进入磁场前有:L=a2t 解得:t0=1 s (2分)
撤去F前:B位移s2=a2t=2 m B的速度v2=a2t0=4 m/s
A位移s1=a2t=8 m A的速度v1=a1t0=16 m/s
相对位移Δs=s1-s2=6 m 撤去F前系统产生的内能Q=μmgΔs=6 J (3分)
撤去F后,设物体能与小车相对静止,设M、m共同速度大小为v,则由动量守恒定律:
Mv1+mv2=(M+m)v 得v=14.7 m/s
因为qvB=3.68 N>mg 所以小车与物体不会相对静止。(2分)
设物体恰好离开小车时的速度为v′2,有:qv′2B=mg得:
v′2=10 m/s (2分)
此时小车速度为v′1,则:Mv1+mv2=Mv′1+mv′2
得:v′1=15.25 m/s (2分)
撤去F后系统产生的内能为:
Q2=mv+mv-mv′-mv′=12.94 J (3分)
即:整个过程中产生的内能为Q=Q1+Q2=18.94 J (2分)
方法二:对小车和物体系统运用能量守恒定律,则Fs1=Mv′+mv′+Q,v′1、v′2由上述方法解得(运用其他方法,结果正确同样给分)。
[解析] 本题考查牛顿运动定律、洛伦兹力、动量守恒、能量守恒,较难题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com